O Arsênico ocorre em muitos minerais, geralmente em combinação com enxofre e metais, mas também como um cristal elementar puro. O arsênico é um metalóide.
Prótons e nêutrons no Arsênico
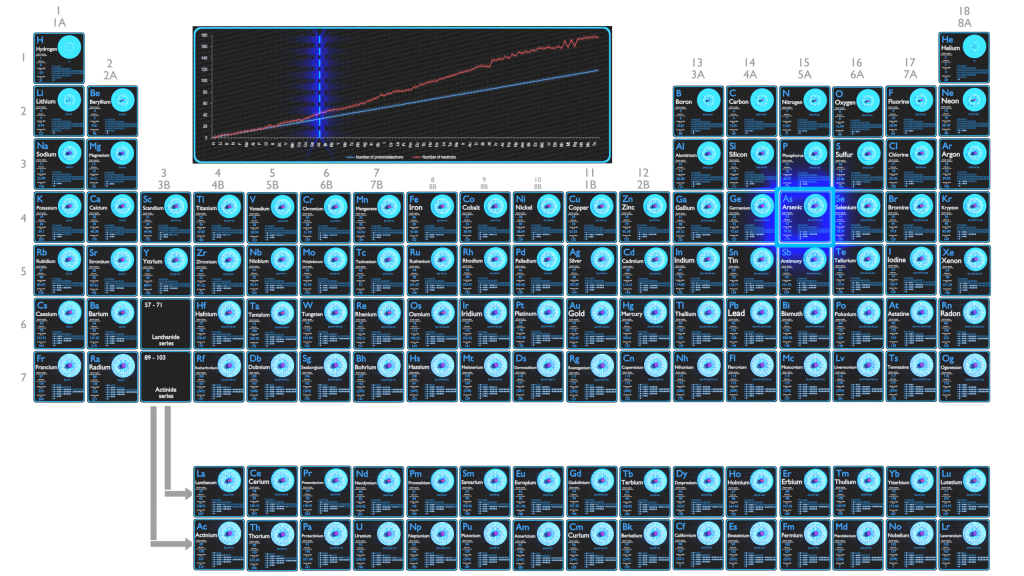
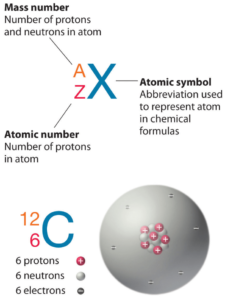 O Arsênico é um elemento químico com número atômico 33, o que significa que existem 33 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.
O Arsênico é um elemento químico com número atômico 33, o que significa que existem 33 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.
O número total de nêutrons no núcleo de um átomo é chamado de número de nêutrons do átomo e recebe o símbolo N. O número de nêutrons mais o número atômico é igual ao número de massa atômica: N+Z=A. A diferença entre o número de nêutrons e o número atômico é conhecida como excesso de nêutrons: D = N – Z = A – 2Z.
Para elementos estáveis, geralmente há uma variedade de isótopos estáveis. Isótopos são nuclídeos que possuem o mesmo número atômico e, portanto, são o mesmo elemento, mas diferem no número de nêutrons. Números de massa de isótopos típicos de Arsênico são 75.
Principais isótopos de Arsênico
Arsênico ocorre apenas um isótopo natural – 75As.
O Arsênico-75 é composto de 33 prótons, 42 nêutrons e 33 elétrons.
Isótopos de ocorrência natural
| Isótopo | Abundância | número de nêutrons |
| 75As | 100% | 42 |
Isótopos Instáveis Típicos
| Isótopo | Meia-vida | Modo Decaimento | produtos |
| 73As | 80,3 d | captura eletrônica | 73Ge |
| 74As | 17,8 d | captura eletrônica | 74Ge |
Elétrons e configuração eletrônica
O número de elétrons em um átomo eletricamente neutro é o mesmo que o número de prótons no núcleo. Portanto, o número de elétrons no átomo neutro de Arsênio é 33. Cada elétron é influenciado pelos campos elétricos produzidos pela carga nuclear positiva e os outros (Z – 1) elétrons negativos no átomo.
Como o número de elétrons e seu arranjo são responsáveis pelo comportamento químico dos átomos, o número atômico identifica os vários elementos químicos. A configuração desses elétrons segue os princípios da mecânica quântica. O número de elétrons nas camadas de elétrons de cada elemento, particularmente na camada de valência mais externa, é o fator primário na determinação de seu comportamento de ligação química. Na tabela periódica, os elementos são listados em ordem crescente de número atômico Z.
A configuração eletrônica do Arsênico é [Ar] 3d10 4s2 4p3.
Possíveis estados de oxidação são +3,5/-3.
Aplicação mais comum de Arsênico
A forma elementar do arsênico é comumente usada em ligas para baterias de chumbo-ácido e bainhas de cabos. Compostos de arsênico também são usados em semicondutores e diodos emissores de luz. O arsênico é usado como agente dopante em semicondutores (arseneto de gálio) para dispositivos de estado sólido. Também é usado em bronzagem, pirotecnia e para endurecimento de granalha.
Resumo
| Elemento | Arsênico |
| Número de prótons | 33 |
| Número de nêutrons (isótopos típicos) | 75 |
| Número de elétrons | 33 |
| configuração eletrônica | [Ar] 3d10 4s2 4p3 |
| Estados de oxidação | +3,5/-3 |
Fonte: www.luciteria.com