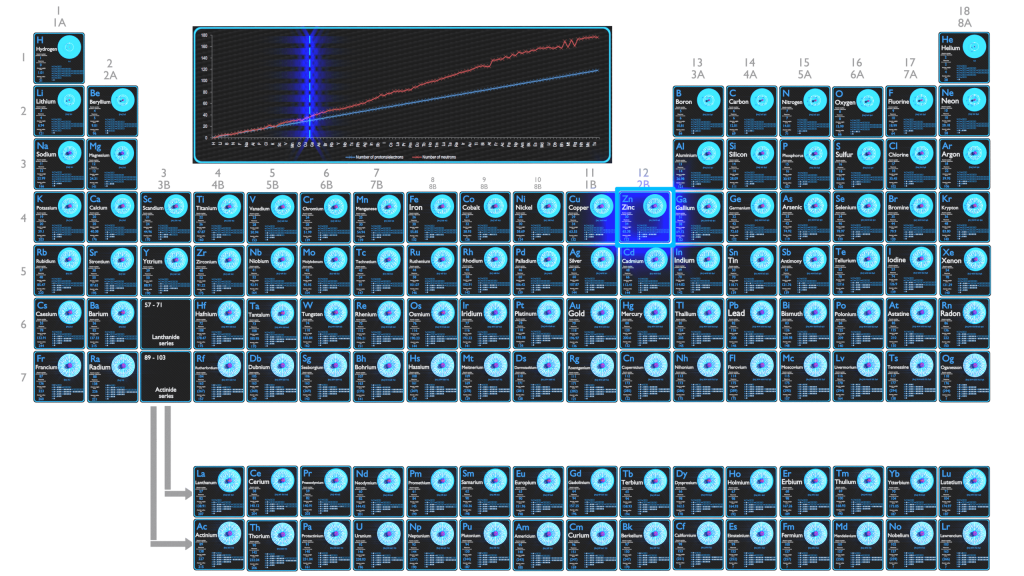
En algunos aspectos, el zinc es químicamente similar al magnesio: ambos elementos exhiben solo un estado de oxidación normal (+2), y los iones Zn2 + y Mg2 + son de tamaño similar. El galvanizado de zinc resistente a la corrosión (galvanizado en caliente) es la principal aplicación del zinc. El revestimiento de acero constituye el uso individual más importante del zinc, pero se utiliza en grandes tonelajes en fundiciones de aleación de zinc, como polvo y óxido de zinc y en productos de zinc forjado. Aproximadamente el 70% del zinc mundial proviene de la minería, mientras que el 30% restante proviene del reciclaje de zinc secundario.
Protones y neutrones en Zinc
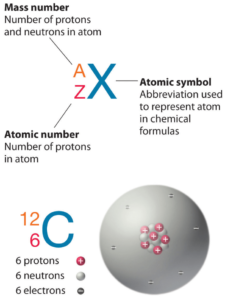 El zinc es un elemento químico con número atómico 30, lo que significa que hay 30 protones en su núcleo. Número total de protones en el núcleo se llama el número atómico del átomo y se le da el símbolo Z . La carga eléctrica total del núcleo es, por tanto, + Ze, donde e (carga elemental) es igual a 1,602 x 10-19 culombios .
El zinc es un elemento químico con número atómico 30, lo que significa que hay 30 protones en su núcleo. Número total de protones en el núcleo se llama el número atómico del átomo y se le da el símbolo Z . La carga eléctrica total del núcleo es, por tanto, + Ze, donde e (carga elemental) es igual a 1,602 x 10-19 culombios .
El número total de neutrones en el núcleo de un átomo se llama el número de neutrones del átomo y se le da el símbolo N . Número de neutrones más el número atómico es igual al número de masa atómica: N + Z = A . La diferencia entre el número de neutrones y el número atómico se conoce como exceso de neutrones : D = N – Z = A – 2Z.
Para los elementos estables, suele haber una variedad de isótopos estables. Los isótopos son nucleidos que tienen el mismo número atómico y, por lo tanto, son el mismo elemento, pero difieren en el número de neutrones. Los números de masa de isótopos típicos de zinc son 64; 66-68; 70.
Principales isótopos de Zinc
En la naturaleza se encuentran 5 isótopos estables de zinc, siendo el 64Zn el isótopo más abundante (49,17% de abundancia natural).
El zinc-64 está compuesto por 30 protones, 34 neutrones y 30 electrones.
El zinc-66 está compuesto por 30 protones, 36 neutrones y 30 electrones.
El zinc-67 está compuesto por 30 protones, 37 neutrones y 30 electrones.
El zinc-68 está compuesto por 30 protones, 38 neutrones y 30 electrones.
El zinc-70 está compuesto por 30 protones, 40 neutrones y 30 electrones.
Isótopos inestables típicos
Electrones y configuración electrónica
El número de electrones en un átomo eléctricamente neutro es el mismo que el número de protones en el núcleo. Por lo tanto, el número de electrones en el átomo neutro de zinc es 30. Cada electrón está influenciado por los campos eléctricos producidos por la carga nuclear positiva y los otros electrones negativos (Z – 1) en el átomo.
Dado que el número de electrones y su disposición son responsables del comportamiento químico de los átomos, el número atómico identifica los diversos elementos químicos. La configuración de estos electrones se deriva de los principios de la mecánica cuántica. El número de electrones en las capas de electrones de cada elemento, particularmente la capa de valencia más externa, es el factor principal para determinar su comportamiento de enlace químico. En la tabla periódica, los elementos se enumeran en orden de número atómico creciente Z.
La configuración electrónica del zinc es [Ar] 3d10 4s2 .
Los posibles estados de oxidación son +2 .
El zinc tiene una configuración electrónica de [Ar] 3d 10 4s 2 y es miembro del grupo 12 de la tabla periódica. Es un metal moderadamente reactivo y un fuerte agente reductor. La superficie del metal puro se empaña rápidamente, formando finalmente una capa protectora pasivante del carbonato de zinc básico, Zn 5 (OH) 6 (CO 3 ) 2 , por reacción con el dióxido de carbono atmosférico.
La química del zinc está dominada por el estado de oxidación +2. Cuando se forman compuestos en este estado de oxidación, se pierden los electrones de la capa exterior , produciendo un ión de zinc desnudo con la configuración electrónica [Ar] 3d 10 .
Aleación de Zinc más importante
Zamak es una familia de aleaciones con un metal base de zinc y elementos de aleación de aluminio, magnesio y cobre. Las aleaciones de zinc con pequeñas cantidades de cobre, aluminio y magnesio son útiles en la fundición a presión y en la fundición por rotación, especialmente en las industrias automotriz, eléctrica y de ferretería. Las aleaciones de zinc tienen puntos de fusión bajos, requieren un aporte de calor relativamente bajo, no requieren atmósferas fundentes o protectoras. Debido a su alta fluidez, las aleaciones de zinc se pueden fundir en paredes mucho más delgadas que otras aleaciones de fundición a presión, y se pueden fundir a presión con tolerancias dimensionales más estrictas.
Acerca de los protones
 Un protón es una de las partículas subatómicas que forman la materia. En el universo, los protones son abundantes y constituyen aproximadamente la mitad de toda la materia visible. Tiene una carga eléctrica positiva (+ 1e) y una masa en reposo igual a 1,67262 × 10 −27 kg ( 938,272 MeV / c 2 ), marginalmente más ligera que la del neutrón pero casi 1836 veces mayor que la del electrón. El protón tiene un radio cuadrático medio de aproximadamente 0,87 × 10 −15 m, o 0,87 fm, y es un fermión de espín ½.
Un protón es una de las partículas subatómicas que forman la materia. En el universo, los protones son abundantes y constituyen aproximadamente la mitad de toda la materia visible. Tiene una carga eléctrica positiva (+ 1e) y una masa en reposo igual a 1,67262 × 10 −27 kg ( 938,272 MeV / c 2 ), marginalmente más ligera que la del neutrón pero casi 1836 veces mayor que la del electrón. El protón tiene un radio cuadrático medio de aproximadamente 0,87 × 10 −15 m, o 0,87 fm, y es un fermión de espín ½.
Los protones existen en los núcleos de los átomos típicos, junto con sus contrapartes neutrales, los neutrones. Los neutrones y protones, comúnmente llamados nucleones , están unidos en el núcleo atómico, donde representan el 99,9 por ciento de la masa del átomo. La investigación en física de partículas de alta energía en el siglo XX reveló que ni el neutrón ni el protón no son los bloques de construcción más pequeños de la materia.
Acerca de los neutrones
Un neutrón es una de las partículas subatómicas que forman la materia. En el universo, los neutrones son abundantes y constituyen más de la mitad de toda la materia visible. No tiene carga eléctrica y una masa en reposo igual a 1,67493 × 10-27 kg, marginalmente mayor que la del protón pero casi 1839 veces mayor que la del electrón. El neutrón tiene un radio cuadrático medio de aproximadamente 0,8 × 10-15 m, o 0,8 fm, y es un fermión de espín ½.
Los núcleos atómicos están formados por protones y neutrones, que se atraen entre sí a través de la fuerza nuclear , mientras que los protones se repelen entre sí a través de la fuerza eléctrica debido a su carga positiva. Estas dos fuerzas compiten, lo que conduce a diversas estabilidades de los núcleos. Solo existen ciertas combinaciones de neutrones y protones, que forman núcleos estables .
Los neutrones estabilizan el núcleo , porque se atraen entre sí y a los protones, lo que ayuda a compensar la repulsión eléctrica entre los protones. Como resultado, a medida que aumenta el número de protones, se necesita una proporción cada vez mayor de neutrones a protones para formar un núcleo estable. Si hay demasiados o muy pocos neutrones para un número determinado de protones, el núcleo resultante no es estable y sufre una desintegración radiactiva . Los isótopos inestables se desintegran a través de varias vías de desintegración radiactiva, más comúnmente desintegración alfa, desintegración beta o captura de electrones. Se conocen muchos otros tipos raros de desintegración, como la fisión espontánea o la emisión de neutrones. Cabe señalar que todas estas vías de desintegración pueden ir acompañadas de la posterior emisión de Radiación gamma . Las desintegraciones alfa o beta puras son muy raras.
Acerca de los electrones y la configuración de los electrones
La tabla periódica es una representación tabular de los elementos químicos organizados sobre la base de sus números atómicos, configuraciones electrónicas y propiedades químicas. La configuración electrónica es la distribución de electrones de un átomo o molécula (u otra estructura física) en orbitales atómicos o moleculares. El conocimiento de la configuración electrónica de diferentes átomos es útil para comprender la estructura de la tabla periódica de elementos.
Todo sólido, líquido, gas y plasma está compuesto por átomos neutros o ionizados. Las propiedades químicas del átomo están determinadas por el número de protones, de hecho, por el número y la disposición de los electrones . La configuración de estos electrones se deriva de los principios de la mecánica cuántica. El número de electrones en las capas de electrones de cada elemento, particularmente la capa de valencia más externa, es el factor principal para determinar su comportamiento de enlace químico. En la tabla periódica, los elementos se enumeran en orden de número atómico creciente Z.
Es el principio de exclusión de Pauli el que requiere que los electrones de un átomo ocupen diferentes niveles de energía en lugar de que todos se condensen en el estado fundamental. El orden de los electrones en el estado fundamental de los átomos multielectrones comienza con el estado de energía más bajo (estado fundamental) y se mueve progresivamente desde allí hacia arriba en la escala de energía hasta que a cada uno de los electrones del átomo se le ha asignado un conjunto único de números cuánticos. Este hecho tiene implicaciones clave para la construcción de la tabla periódica de elementos.
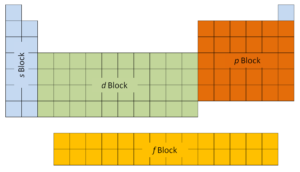 Las dos primeras columnas en el lado izquierdo de la tabla periódica son donde los s están siendo ocupados subniveles. Debido a esto, las dos primeras filas de la tabla periódica se denominan bloque s . De manera similar, el bloque p son las seis columnas más a la derecha de la tabla periódica, el bloque d son las 10 columnas centrales de la tabla periódica, mientras que el bloque f es la sección de 14 columnas que normalmente se representa separada del cuerpo principal. de la tabla periódica. Podría ser parte del cuerpo principal, pero la tabla periódica sería bastante larga y engorrosa.
Las dos primeras columnas en el lado izquierdo de la tabla periódica son donde los s están siendo ocupados subniveles. Debido a esto, las dos primeras filas de la tabla periódica se denominan bloque s . De manera similar, el bloque p son las seis columnas más a la derecha de la tabla periódica, el bloque d son las 10 columnas centrales de la tabla periódica, mientras que el bloque f es la sección de 14 columnas que normalmente se representa separada del cuerpo principal. de la tabla periódica. Podría ser parte del cuerpo principal, pero la tabla periódica sería bastante larga y engorrosa.
En el caso de átomos con muchos electrones, esta notación puede ser larga, por lo que se utiliza una notación abreviada. La configuración electrónica se puede visualizar como los electrones del núcleo, equivalentes al gas noble del período anterior, y los electrones de valencia (por ejemplo, [Xe] 6s2 para el bario).
Estados de oxidación
Los estados de oxidación se representan típicamente por números enteros que pueden ser positivos, cero o negativos. La mayoría de los elementos tienen más de un posible estado de oxidación. Por ejemplo, el carbono tiene nueve posibles estados de oxidación enteros de -4 a +4.
La definición actual del estado de oxidación del Libro de Oro de la IUPAC es:
«El estado de oxidación de un átomo es la carga de este átomo después de la aproximación iónica de sus enlaces heteronucleares …»
y el término número de oxidación es casi sinónimo. Un elemento que no está combinado con ningún otro elemento diferente tiene un estado de oxidación de 0. El estado de oxidación 0 ocurre para todos los elementos – es simplemente el elemento en su forma elemental. Un átomo de un elemento en un compuesto tendrá un estado de oxidación positivo si se le han eliminado electrones. De manera similar, la adición de electrones da como resultado un estado de oxidación negativo. También hemos distinguido entre los estados de oxidación posibles y comunes de cada elemento. Por ejemplo, el silicio tiene nueve posibles estados de oxidación enteros de -4 a +4, pero solo -4, 0 y +4 son estados de oxidación comunes.
Resumen
| Elemento |
Zinc |
| Numero de protones |
30 |
| Número de neutrones (isótopos típicos) |
64; 66-68; 70 |
| Numero de electrones |
30 |
| Configuración electronica |
[Ar] 3d10 4s2 |
| Estados de oxidación |
+2 |

Fuente: www.luciteria.com
Propiedades de otros elementos
Otras propiedades del Zinc
 El zinc es un elemento químico con número atómico 30, lo que significa que hay 30 protones en su núcleo. Número total de protones en el núcleo se llama el número atómico del átomo y se le da el símbolo Z . La carga eléctrica total del núcleo es, por tanto, + Ze, donde e (carga elemental) es igual a 1,602 x 10-19 culombios .
El zinc es un elemento químico con número atómico 30, lo que significa que hay 30 protones en su núcleo. Número total de protones en el núcleo se llama el número atómico del átomo y se le da el símbolo Z . La carga eléctrica total del núcleo es, por tanto, + Ze, donde e (carga elemental) es igual a 1,602 x 10-19 culombios .