L’arsenic est présent dans de nombreux minéraux, généralement en combinaison avec du soufre et des métaux, mais aussi sous forme de cristal élémentaire pur. L’arsenic est un métalloïde.
Protons et neutrons dans l’Arsenic
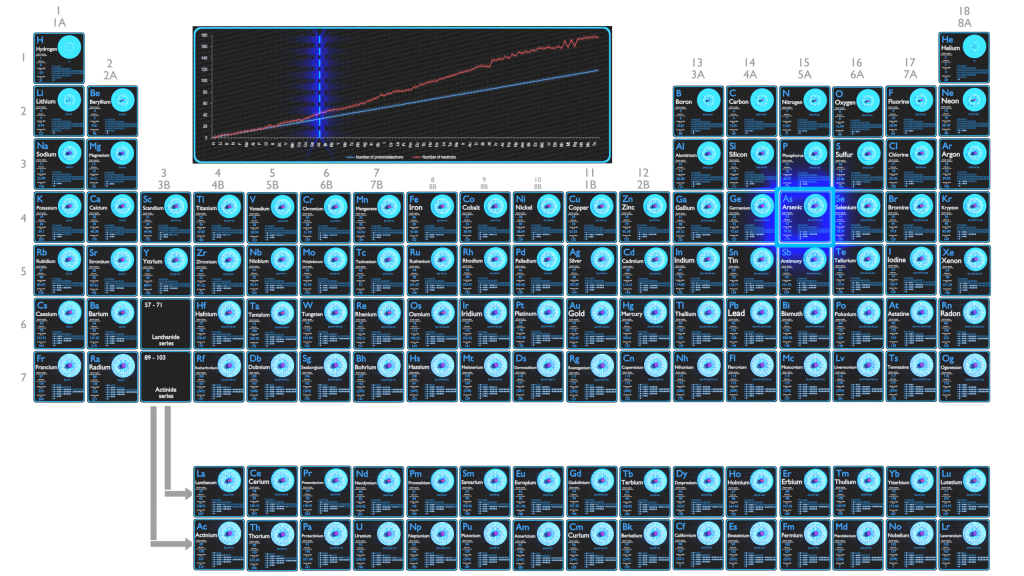
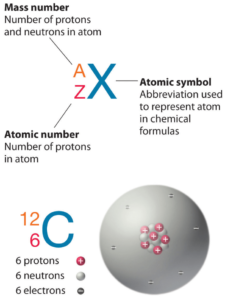 L’arsenic est un élément chimique de numéro atomique 33, ce qui signifie qu’il y a 33 protons dans son noyau. Le nombre total de protons dans le noyau est appelé le numéro atomique de l’atome et reçoit le symbole Z. La charge électrique totale du noyau est donc +Ze, où e (charge élémentaire) vaut 1 602 x 10-19 coulombs.
L’arsenic est un élément chimique de numéro atomique 33, ce qui signifie qu’il y a 33 protons dans son noyau. Le nombre total de protons dans le noyau est appelé le numéro atomique de l’atome et reçoit le symbole Z. La charge électrique totale du noyau est donc +Ze, où e (charge élémentaire) vaut 1 602 x 10-19 coulombs.
Le nombre total de neutrons dans le noyau d’un atome est appelé le nombre de neutrons de l’atome et reçoit le symbole N. Le nombre de neutrons plus le numéro atomique est égal au nombre de masse atomique: N+Z=A . La différence entre le nombre de neutrons et le numéro atomique est appelée excès de neutrons: D = N – Z = A – 2Z.
Pour les éléments stables, il existe généralement une variété d’isotopes stables. Les isotopes sont des nucléides qui ont le même numéro atomique et sont donc le même élément, mais diffèrent par le nombre de neutrons. Les nombres de masse des isotopes typiques de l’arsenic sont de 75.
Principaux isotopes de l’Arsenic
L’arsenic ne produit qu’un seul isotope naturel – 75As.
L’arsenic-75 est composé de 33 protons, 42 neutrons et 33 électrons.
Isotopes instables typiques
| Isotope | Demi-vie | Mode de décomposition | Produit |
| 73As | 80,3 j | capture d’électrons | 73Ge |
| 74As | 17,8 j | capture d’électrons | 74Ge |
Électrons et configuration électronique
Le nombre d’électrons dans un atome électriquement neutre est le même que le nombre de protons dans le noyau. Par conséquent, le nombre d’électrons dans l’atome neutre d’ arsenic est de 33. Chaque électron est influencé par les champs électriques produits par la charge nucléaire positive et les autres (Z – 1) électrons négatifs de l’atome.
Puisque le nombre d’électrons et leur disposition sont responsables du comportement chimique des atomes, le numéro atomique identifie les différents éléments chimiques. La configuration de ces électrons découle des principes de la mécanique quantique. Le nombre d’électrons dans les couches d’électrons de chaque élément, en particulier la couche de valence la plus externe, est le principal facteur déterminant son comportement de liaison chimique. Dans le tableau périodique, les éléments sont classés par ordre croissant de numéro atomique Z.
La configuration électronique de l’arsenic est [Ar] 3d10 4s2 4p3.
Les états d’oxydation possibles sont +3,5/-3.
Application la plus courante de l’Arsenic
La forme élémentaire de l’arsenic est couramment utilisée dans les alliages pour les batteries au plomb et les gaines de câbles. Les composés d’arsenic sont également utilisés dans les semi- conducteurs et les diodes électroluminescentes. L’arsenic est utilisé comme agent dopant dans les semi-conducteurs (arséniure de gallium) pour les dispositifs à semi-conducteurs. Il est également utilisé en bronzage, en pyrotechnie et pour le durcissement de la grenaille.
Résumé
| Élément | Arsenic |
| Nombre de protons | 33 |
| Nombre de neutrons (isotopes typiques) | 75 |
| Nombre d’électrons | 33 |
| Configuration électronique | [Ar] 3d10 4s2 4p3 |
| États d’oxydation | + 3,5 / -3 |
Source : www.luciteria.com