icon : info-circle
L’oxygène est un gaz réactif incolore et inodore, l’élément chimique de numéro atomique 8 et le composant vital de l’air. C’est un membre du groupe chalcogène du tableau périodique, un non-métal hautement réactif et un agent oxydant qui forme facilement des oxydes avec la plupart des éléments ainsi qu’avec d’autres composés.
Les utilisations courantes de l’oxygène comprennent la production d’acier, de plastiques et de textiles, le brasage, le soudage et le découpage d’aciers et d’autres métaux, le propulseur de fusée, l’oxygénothérapie et les systèmes de survie dans les avions, les sous-marins, les vols spatiaux et la plongée.
Chaque année, cent millions de tonnes d’oxygène sont extraites de l’air à des fins industrielles par deux méthodes principales. La méthode la plus courante est la distillation fractionnée de l’air liquéfié, l’azote distillant sous forme de vapeur tandis que l’oxygène reste sous forme liquide. L’autre méthode principale de production d’oxygène consiste à faire passer un flux d’air propre et sec à travers un lit d’une paire de tamis moléculaires zéolitiques identiques, qui absorbe l’azote et délivre un flux gazeux contenant 90 % à 93 % d’oxygène.
icon : plus-circle
Protons et neutrons dans l’Oxygène
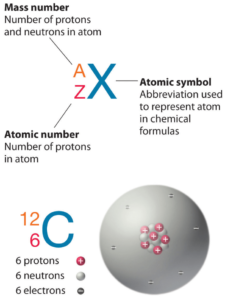 L’oxygène est un élément chimique de numéro atomique 8, ce qui signifie qu’il y a 8 protons dans son noyau. Le nombre total de protons dans le noyau est appelé le numéro atomique de l’atome et reçoit le symbole Z. La charge électrique totale du noyau est donc +Ze, où e (charge élémentaire) vaut 1 602 x 10-19 coulombs.
L’oxygène est un élément chimique de numéro atomique 8, ce qui signifie qu’il y a 8 protons dans son noyau. Le nombre total de protons dans le noyau est appelé le numéro atomique de l’atome et reçoit le symbole Z. La charge électrique totale du noyau est donc +Ze, où e (charge élémentaire) vaut 1 602 x 10-19 coulombs.
Le nombre total de neutrons dans le noyau d’un atome est appelé le nombre de neutrons de l’atome et reçoit le symbole N. Le nombre de neutrons plus le numéro atomique est égal au nombre de masse atomique: N+Z=A. La différence entre le nombre de neutrons et le numéro atomique est appelée excès de neutrons: D = N – Z = A – 2Z.
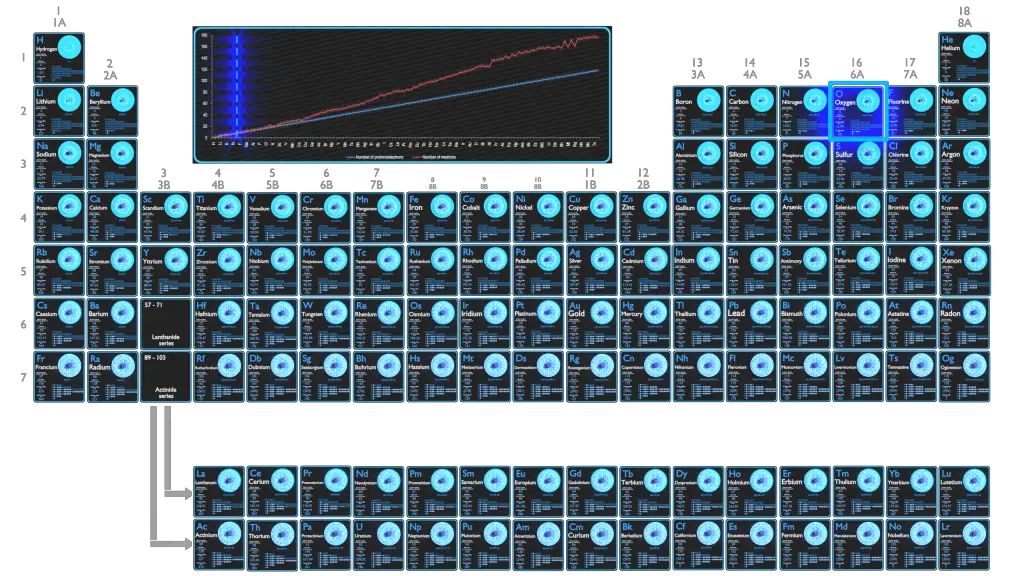
Pour les éléments stables, il existe généralement une variété d’isotopes stables. Les isotopes sont des nucléides qui ont le même numéro atomique et sont donc le même élément, mais diffèrent par le nombre de neutrons. Les nombres de masse des isotopes typiques de l’ oxygène sont de 16; 17; 18.
Principaux isotopes de l’Oxygène
L’oxygène naturel est composé de trois isotopes stables, 16O, 17O et 18O, 16O étant le plus abondant (abondance naturelle de 99,762 %).
L’oxygène-16 est composé de 8 protons, 8 neutrons et 8 électrons. La majeure partie du 16O est synthétisée à la fin du processus de fusion de l’hélium dans les étoiles ; la réaction triple alpha crée du 12C, qui capte un 4He supplémentaire pour faire du 16O. L’abondance relative et absolue de 16O est élevée car c’est un produit principal de l’évolution stellaire.
L’oxygène-17 est composé de 8 protons, 9 neutrons et 8 électrons. 17O et 18O sont tous deux des isotopes secondaires, ce qui signifie que leur nucléosynthèse nécessite des noyaux germinatifs.
L’oxygène-18 est composé de 8 protons, 10 neutrons et 8 électrons.
L’oxygène-15, qui est un isotope instable de l’oxygène, est composé de 8 protons, 7 neutrons et 8 électrons. Il est fréquemment utilisé en tomographie par émission de positrons ou en imagerie TEP. L’oxygène-15 est synthétisé par bombardement deutéron d’azote-14 à l’aide d’un cyclotron.
Isotopes instables typiques
icon : réagir
Électrons et configuration électronique
Le nombre d’électrons dans un atome électriquement neutre est le même que le nombre de protons dans le noyau. Par conséquent, le nombre d’électrons dans l’atome neutre d’ oxygène est de 8. Chaque électron est influencé par les champs électriques produits par la charge nucléaire positive et les autres (Z – 1) électrons négatifs de l’atome.
Puisque le nombre d’électrons et leur disposition sont responsables du comportement chimique des atomes, le numéro atomique identifie les différents éléments chimiques. La configuration de ces électrons découle des principes de la mécanique quantique. Le nombre d’électrons dans les couches d’électrons de chaque élément, en particulier la couche de valence la plus externe, est le principal facteur déterminant son comportement de liaison chimique. Dans le tableau périodique, les éléments sont classés par ordre croissant de numéro atomique Z.
La configuration électronique de l’ oxygène est [He] 2s2 2p4.
Les états d’oxydation possibles sont -2.
L’oxygène est trop réactif chimiquement pour rester un élément libre dans l’air sans être renouvelé en permanence par l’action photosynthétique des organismes vivants. C’est un agent oxydant puissant avec une électronégativité élevée et forme de l’O2 à température et pression standard (STP). Les oxydes métalliques contiennent généralement un anion d’oxygène à l’état d’oxydation de -2. La majeure partie de la croûte terrestre est constituée d’oxydes solides, résultat d’éléments oxydés par l’oxygène de l’air ou de l’eau. Même les matériaux considérés comme des éléments purs développent souvent une couche d’oxyde. Par exemple, une feuille d’aluminium développe une fine peau d’Al 2O3(appelée couche de passivation) qui protège la feuille d’une corrosion supplémentaire. En raison de son électronégativité, l’oxygène forme des liaisons chimiques stables avec presque tous les éléments pour donner les oxydes correspondants.
icon : nextcloud
Composé chimique le plus courant de l’Oxygène
L’eau est le composé chimique le plus courant de l’hydrogène et de l’oxygène. Sa formule chimique est H2O, ce qui signifie que chacune de ses molécules contient un atome d’oxygène et deux atomes d’hydrogène, reliés par des liaisons covalentes. Deux atomes d’hydrogène attachés à un atome d’oxygène à un angle de 104,45°.
À propos des protons
 Un proton est l’une des particules subatomiques qui composent la matière. Dans l’univers, les protons sont abondants, constituant environ la moitié de toute la matière visible. Il a une charge électrique positive (+1e) et une masse au repos égale à 1,67262 × 10−27 kg (938,272 MeV/c2) — légèrement plus léger que celui du neutron mais près de 1836 fois supérieur à celui de l’électron. Le proton a un rayon carré moyen d’environ 0,87 × 10−15 m, ou 0,87 fm, et c’est un spin – ½ fermion.
Un proton est l’une des particules subatomiques qui composent la matière. Dans l’univers, les protons sont abondants, constituant environ la moitié de toute la matière visible. Il a une charge électrique positive (+1e) et une masse au repos égale à 1,67262 × 10−27 kg (938,272 MeV/c2) — légèrement plus léger que celui du neutron mais près de 1836 fois supérieur à celui de l’électron. Le proton a un rayon carré moyen d’environ 0,87 × 10−15 m, ou 0,87 fm, et c’est un spin – ½ fermion.
Les protons existent dans les noyaux des atomes typiques, avec leurs homologues neutres, les neutrons. Les neutrons et les protons, communément appelés nucléons, sont liés ensemble dans le noyau atomique, où ils représentent 99,9 % de la masse de l’atome. Les recherches en physique des particules de haute énergie au XXe siècle ont révélé que ni le neutron ni le proton ne sont le plus petit élément constitutif de la matière.
À propos des neutrons
Un neutron est l’une des particules subatomiques qui composent la matière. Dans l’univers, les neutrons sont abondants, constituant plus de la moitié de toute la matière visible. Il n’a pas de charge électrique et une masse au repos égale à 1,67493 × 10−27 kg – légèrement supérieure à celle du proton mais près de 1839 fois supérieure à celle de l’électron. Le neutron a un rayon carré moyen d’environ 0,8 × 10−15 m, ou 0,8 fm, et c’est un fermion de spin ½.
Les noyaux atomiques sont constitués de protons et de neutrons, qui s’attirent par la force nucléaire, tandis que les protons se repoussent par la force électrique en raison de leur charge positive. Ces deux forces entrent en compétition, conduisant à diverses stabilités des noyaux. Il n’y a que certaines combinaisons de neutrons et de protons, qui forment des noyaux stables.
Les neutrons stabilisent le noyau, car ils s’attirent ainsi que les protons, ce qui permet de compenser la répulsion électrique entre les protons. En conséquence, à mesure que le nombre de protons augmente, un rapport croissant de neutrons sur protons est nécessaire pour former un noyau stable. S’il y a trop ou trop peu de neutrons pour un nombre donné de protons, le noyau résultant n’est pas stable et il subit une désintégration radioactive. Les isotopes instables se désintègrent par diverses voies de désintégration radioactive, le plus souvent la désintégration alpha, la désintégration bêta ou la capture d’électrons. De nombreux autres types de désintégration rares, tels que la fission spontanée ou l’émission de neutrons, sont connus. Il convient de noter que toutes ces voies de désintégration peuvent s’accompagner de l’émission subséquente de rayonnement gamma. Les désintégrations alpha ou bêta pures sont très rares.
À propos des électrons et de la configuration des électrons
Le tableau périodique est un affichage tabulaire des éléments chimiques organisés en fonction de leurs numéros atomiques, de leurs configurations électroniques et de leurs propriétés chimiques. La configuration électronique est la distribution des électrons d’un atome ou d’une molécule (ou d’une autre structure physique) dans des orbitales atomiques ou moléculaires. La connaissance de la configuration électronique des différents atomes est utile pour comprendre la structure du tableau périodique des éléments.
Chaque solide, liquide, gaz et plasma est composé d’atomes neutres ou ionisés. Les propriétés chimiques de l’atome sont déterminées par le nombre de protons, en fait, par le nombre et la disposition des électrons. La configuration de ces électrons découle des principes de la mécanique quantique. Le nombre d’électrons dans les couches d’électrons de chaque élément, en particulier la couche de valence la plus externe, est le principal facteur déterminant son comportement de liaison chimique. Dans le tableau périodique, les éléments sont classés par ordre croissant de numéro atomique Z.
C’est le principe d’exclusion de Pauli qui exige que les électrons d’un atome occupent différents niveaux d’énergie au lieu qu’ils se condensent tous dans l’état fondamental. L’ordre des électrons dans l’état fondamental des atomes multiélectrons commence par l’état d’énergie le plus bas (état fondamental) et se déplace progressivement de là vers le haut de l’échelle d’énergie jusqu’à ce que chacun des électrons de l’atome se soit vu attribuer un ensemble unique de nombres quantiques. Ce fait a des implications essentielles pour la construction du tableau périodique des éléments.
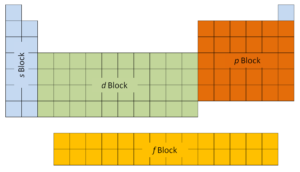 Les deux premières colonnes sur le côté gauche du tableau périodique sont celles où les sous-couches s sont occupées. Pour cette raison, les deux premières lignes du tableau périodique sont étiquetées le bloc s. De même, le bloc p sont les six colonnes les plus à droite du tableau périodique, le bloc d est les 10 colonnes du milieu du tableau périodique, tandis que le bloc f est la section de 14 colonnes qui est normalement représentée comme détachée du corps principal. du tableau périodique. Il pourrait faire partie du corps principal, mais alors le tableau périodique serait plutôt long et encombrant.
Les deux premières colonnes sur le côté gauche du tableau périodique sont celles où les sous-couches s sont occupées. Pour cette raison, les deux premières lignes du tableau périodique sont étiquetées le bloc s. De même, le bloc p sont les six colonnes les plus à droite du tableau périodique, le bloc d est les 10 colonnes du milieu du tableau périodique, tandis que le bloc f est la section de 14 colonnes qui est normalement représentée comme détachée du corps principal. du tableau périodique. Il pourrait faire partie du corps principal, mais alors le tableau périodique serait plutôt long et encombrant.
Pour les atomes avec de nombreux électrons, cette notation peut devenir longue et donc une notation abrégée est utilisée. La configuration électronique peut être visualisée comme les électrons de cœur, équivalents au gaz noble de la période précédente, et les électrons de valence (par exemple [Xe] 6s2 pour le baryum).
États d’oxydation
Les états d’oxydation sont généralement représentés par des nombres entiers qui peuvent être positifs, nuls ou négatifs. La plupart des éléments ont plus d’un état d’oxydation possible. Par exemple, le carbone a neuf états d’oxydation entiers possibles de -4 à +4.
La définition actuelle de l’état d’oxydation du livre d’or IUPAC est:
« L’état d’oxydation d’un atome est la charge de cet atome après approximation ionique de ses liaisons hétéronucléaires… »
et le terme nombre d’oxydation est presque synonyme. Un élément qui n’est combiné à aucun autre élément différent a un état d’oxydation de 0. L’état d’oxydation 0 se produit pour tous les éléments – c’est simplement l’élément sous sa forme élémentaire. Un atome d’un élément dans un composé aura un état d’oxydation positif s’il a eu des électrons retirés. De même, l’ajout d’électrons entraîne un état d’oxydation négatif. Nous avons également distingué les états d’oxydation possibles et communs de chaque élément. Par exemple, le silicium a neuf états d’oxydation entiers possibles de -4 à +4, mais seuls -4, 0 et +4 sont des états d’oxydation communs.
Résumé
| Élément |
Oxygène |
| Nombre de protons |
8 |
| Nombre de neutrons (isotopes typiques) |
16; 17; 18 |
| Nombre d’électrons |
8 |
| Configuration électronique |
[Il] 2s2 2p4 |
| États d’oxydation |
-2 |

Source : www.luciteria.com
Propriétés des autres éléments
Autres propriétés de l’Oxygène
 L’oxygène est un élément chimique de numéro atomique 8, ce qui signifie qu’il y a 8 protons dans son noyau. Le nombre total de protons dans le noyau est appelé le numéro atomique de l’atome et reçoit le symbole Z. La charge électrique totale du noyau est donc +Ze, où e (charge élémentaire) vaut 1 602 x 10-19 coulombs.
L’oxygène est un élément chimique de numéro atomique 8, ce qui signifie qu’il y a 8 protons dans son noyau. Le nombre total de protons dans le noyau est appelé le numéro atomique de l’atome et reçoit le symbole Z. La charge électrique totale du noyau est donc +Ze, où e (charge élémentaire) vaut 1 602 x 10-19 coulombs.