O Actínio é um metal radioativo macio, branco prateado. O actínio deu o nome à série dos actinídeos, um grupo de 15 elementos semelhantes entre o actínio e o laurêncio na tabela periódica.
Prótons e nêutrons no Actínio
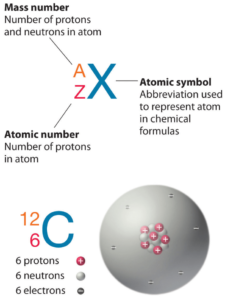 O Actínio é um elemento químico com número atômico 89, o que significa que existem 89 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.
O Actínio é um elemento químico com número atômico 89, o que significa que existem 89 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.
O número total de nêutrons no núcleo de um átomo é chamado de número de nêutrons do átomo e recebe o símbolo N. O número de nêutrons mais o número atômico é igual ao número de massa atômica: N+Z=A. A diferença entre o número de nêutrons e o número atômico é conhecida como excesso de nêutrons: D = N – Z = A – 2Z.
Para elementos estáveis, geralmente há uma variedade de isótopos estáveis. Isótopos são nuclídeos que possuem o mesmo número atômico e, portanto, são o mesmo elemento, mas diferem no número de nêutrons. Números de massa de isótopos típicos de Actínio são 227.
Principais isótopos de Actínio
O Actínio ocorre em 2 isótopos naturais: 225Ac e 227Ac. Todos os isótopos são muito ligeiramente radioativos ocorrem apenas em traços.
O Actínio-225 é composto de 89 prótons, 136 nêutrons e 89 elétrons.
O Actínio-227 é composto de 89 prótons, 138 nêutrons e 89 elétrons.
Isótopos de ocorrência natural
| Isótopo | Abundância | número de nêutrons |
| 225Ac (instável) | vestígio | 136 |
| 227Ac (instável) | vestígio | 138 |
Isótopos Instáveis Típicos
| Isótopo | Meia-vida | Modo Decaimento | produtos |
| 225Ac | 10 d | decaimento alfa | 221Fr |
| 226Ac | 29,37 h | decaimento beta ou captura eletrônica ou decaimento alfa | 2 26Th ou 226Ra ou 222Fr |
| 227Ac | 21,772 a | decaimento beta ou decaimento alfa | 227Th ou 223Fr |
Elétrons e configuração eletrônica
O número de elétrons em um átomo eletricamente neutro é o mesmo que o número de prótons no núcleo. Portanto, o número de elétrons no átomo neutro do Actínio é 89. Cada elétron é influenciado pelos campos elétricos produzidos pela carga nuclear positiva e os outros (Z – 1) elétrons negativos no átomo.
Como o número de elétrons e seu arranjo são responsáveis pelo comportamento químico dos átomos, o número atômico identifica os vários elementos químicos. A configuração desses elétrons segue os princípios da mecânica quântica. O número de elétrons nas camadas de elétrons de cada elemento, particularmente na camada de valência mais externa, é o fator primário na determinação de seu comportamento de ligação química. Na tabela periódica, os elementos são listados em ordem crescente de número atômico Z.
A configuração eletrônica do Actínio é [Rn] 6d1 7s2.
Possíveis estados de oxidação são +3.
Resumo
| Elemento | Actínio |
| Número de prótons | 89 |
| Número de nêutrons (isótopos típicos) | 227 |
| Número de elétrons | 89 |
| configuração eletrônica | [Rn] 6d1 7s2 |
| Estados de oxidação | +3 |
Fonte: www.luciteria.com