Como elemento, o fósforo existe em duas formas principais – Fósforo branco e fósforo vermelho – mas, por ser altamente reativo, o Fósforo nunca é encontrado como elemento livre na Terra.
A grande maioria dos compostos de Fósforo extraídos são consumidos como fertilizantes. O fosfato é necessário para repor o Fósforo que as plantas retiram do solo, e sua demanda anual aumenta quase duas vezes mais rápido que o crescimento da população humana.
A fonte predominante de Fósforo nos tempos modernos é a rocha fosfática (em oposição ao guano que a precedeu).
Prótons e nêutrons no Fósforo
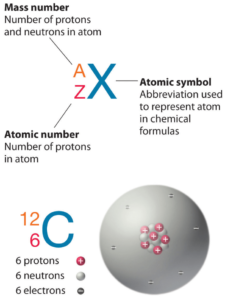 O Fósforo é um elemento químico com número atômico 15, o que significa que existem 15 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.
O Fósforo é um elemento químico com número atômico 15, o que significa que existem 15 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.
O número total de nêutrons no núcleo de um átomo é chamado de número de nêutrons do átomo e recebe o símbolo N. O número de nêutrons mais o número atômico é igual ao número de massa atômica: N+Z=A. A diferença entre o número de nêutrons e o número atômico é conhecida como excesso de nêutrons: D = N – Z = A – 2Z.
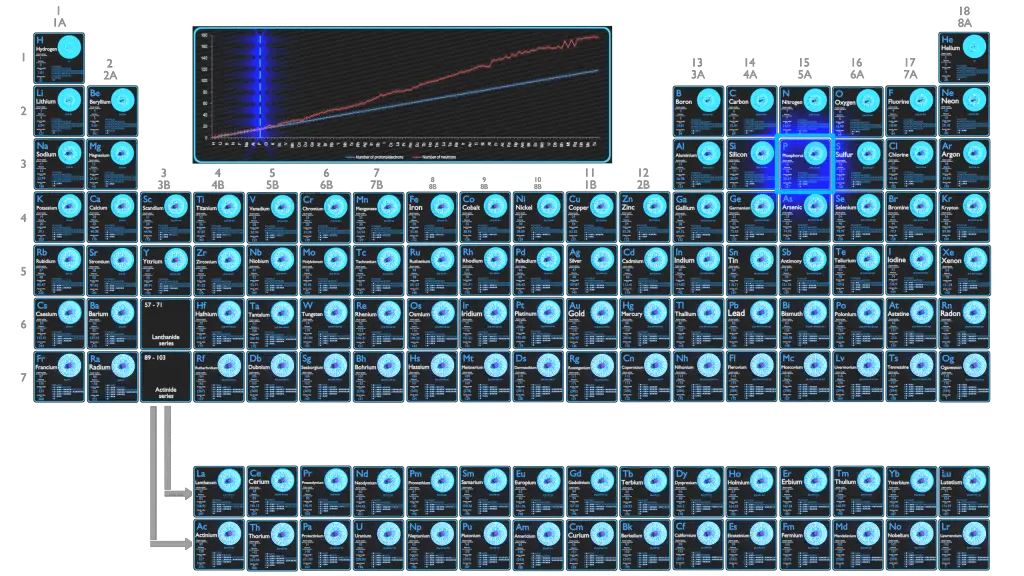
Para elementos estáveis, geralmente há uma variedade de isótopos estáveis. Isótopos são nuclídeos que possuem o mesmo número atômico e, portanto, são o mesmo elemento, mas diferem no número de nêutrons. Números de massa de isótopos típicos de Fósforo são 31.
Principais Isótopos do Fósforo
São conhecidos 23 isótopos de Fósforo, variando de 25P a 47P. Apenas o 31P é estável e, portanto, está presente em 100% de abundância.
O Fósforo-31 é composto por 15 prótons, 16 nêutrons e 15 elétrons. O spin nuclear semi-inteiro e a alta abundância de 31P tornam a espectroscopia de NMR de fósforo-31 uma ferramenta analítica muito útil em estudos de amostras contendo fósforo.
O Fósforo-32 é composto de 15 prótons, 17 nêutrons e 15 elétrons. 32P, um emissor beta (1,71 MeV) com meia-vida de 14,3 dias, que é usado rotineiramente em laboratórios de ciências da vida, principalmente para produzir sondas de DNA e RNA marcadas radioativamente.
O Fósforo-33 é composto por 15 prótons, 18 nêutrons e 15 elétrons. 33P, um emissor beta (0,25 MeV) com meia-vida de 25,4 dias. Ele é usado em laboratórios de ciências da vida em aplicações nas quais as emissões beta de energia mais baixa são vantajosas, como o sequenciamento de DNA.
Isótopos Instáveis Típicos
Elétrons e configuração eletrônica
O número de elétrons em um átomo eletricamente neutro é o mesmo que o número de prótons no núcleo. Portanto, o número de elétrons no átomo neutro de Fósforo é 15. Cada elétron é influenciado pelos campos elétricos produzidos pela carga nuclear positiva e os outros (Z – 1) elétrons negativos no átomo.
Como o número de elétrons e seu arranjo são responsáveis pelo comportamento químico dos átomos, o número atômico identifica os vários elementos químicos. A configuração desses elétrons segue os princípios da mecânica quântica. O número de elétrons nas camadas de elétrons de cada elemento, particularmente na camada de valência mais externa, é o fator primário na determinação de seu comportamento de ligação química. Na tabela periódica, os elementos são listados em ordem crescente de número atômico Z.
A configuração eletrônica do Fósforo é [Ne] 3s2 3p3.
Possíveis estados de oxidação são +3,5/-3.
Como elemento, o fósforo existe em duas formas principais – fósforo branco e fósforo vermelho – mas, por ser altamente reativo, o fósforo nunca é encontrado como elemento livre na Terra. Os compostos mais prevalentes de fósforo são derivados de fosfato, um ânion tetraédrico. O fosfato é a base conjugada do ácido fosfórico, produzida em grande escala para uso em fertilizantes.
Composto mais comum de Fósforo
O ácido Fosfórico é um ácido fraco com a fórmula química H3PO4. O ácido fosfórico de grau alimentício é usado para acidificar alimentos e bebidas, como várias colas e geléias, proporcionando um sabor picante ou azedo. Os refrigerantes que contêm ácido fosfórico, que incluem a Coca-Cola, às vezes são chamados de refrigerantes de fosfato ou fosfatos.
Sobre os prótons
 Um próton é uma das partículas subatômicas que compõem a matéria. No universo, os prótons são abundantes, constituindo cerca de metade de toda a matéria visível. Ele tem uma carga elétrica positiva (+1e) e uma massa de repouso igual a 1,67262 × 10−27 kg (938,272 MeV/c2) — ligeiramente mais leve que a do nêutron, mas quase 1,836 vezes maior que a do elétron. O próton tem um raio quadrado médio de cerca de 0,87 × 10−15 m, ou 0,87 fm, e é um spin – ½ férmion.
Um próton é uma das partículas subatômicas que compõem a matéria. No universo, os prótons são abundantes, constituindo cerca de metade de toda a matéria visível. Ele tem uma carga elétrica positiva (+1e) e uma massa de repouso igual a 1,67262 × 10−27 kg (938,272 MeV/c2) — ligeiramente mais leve que a do nêutron, mas quase 1,836 vezes maior que a do elétron. O próton tem um raio quadrado médio de cerca de 0,87 × 10−15 m, ou 0,87 fm, e é um spin – ½ férmion.
Os prótons existem nos núcleos de átomos típicos, junto com suas contrapartes neutras, os nêutrons. Nêutrons e prótons, comumente chamados de núcleons, estão unidos no núcleo atômico, onde representam 99,9% da massa do átomo. A pesquisa em física de partículas de alta energia no século 20 revelou que nem o nêutron nem o próton não são o menor bloco de construção da matéria.
Sobre Neutrons
Um nêutron é uma das partículas subatômicas que compõem a matéria. No universo, os nêutrons são abundantes, constituindo mais da metade de toda a matéria visível. Ele não tem carga elétrica e uma massa de repouso igual a 1,67493 × 10−27 kg – ligeiramente maior que a do próton, mas quase 1,839 vezes maior que a do elétron. O nêutron tem um raio quadrado médio de cerca de 0,8 × 10−15 m, ou 0,8 fm, e é um férmion spin-½.
Os núcleos atômicos consistem em prótons e nêutrons, que se atraem através da força nuclear, enquanto os prótons se repelem através da força elétrica devido à sua carga positiva. Essas duas forças competem, levando a várias estabilidades de núcleos. Existem apenas certas combinações de nêutrons e prótons, que formam núcleos estáveis .
Os nêutrons estabilizam o núcleo, pois atraem uns aos outros e os prótons, o que ajuda a compensar a repulsão elétrica entre os prótons. Como resultado, à medida que o número de prótons aumenta, uma proporção crescente de nêutrons para prótons é necessária para formar um núcleo estável. Se houver muitos ou poucos nêutrons para um determinado número de prótons, o núcleo resultante não é estável e sofre decaimento radioativo. Isótopos instáveis decaem através de vários caminhos de decaimento radioativo, mais comumente decaimento alfa, decaimento beta ou captura de elétrons. Muitos outros tipos raros de decaimento, como fissão espontânea ou emissão de nêutrons, são conhecidos. Deve-se notar que todas essas vias de decaimento podem ser acompanhadas pela subsequente emissão de radiação gama. Decaimentos alfa ou beta puros são muito raros.
Sobre elétrons e configuração de elétrons
A tabela periódica é uma exibição tabular dos elementos químicos organizados com base em seus números atômicos, configurações eletrônicas e propriedades químicas. A configuração eletrônica é a distribuição de elétrons de um átomo ou molécula (ou outra estrutura física) em orbitais atômicos ou moleculares. O conhecimento da configuração eletrônica de diferentes átomos é útil para entender a estrutura da tabela periódica dos elementos.
Todo sólido, líquido, gás e plasma é composto de átomos neutros ou ionizados. As propriedades químicas do átomo são determinadas pelo número de prótons, na verdade, pelo número e disposição dos elétrons. A configuração desses elétrons segue os princípios da mecânica quântica. O número de elétrons nas camadas de elétrons de cada elemento, particularmente na camada de valência mais externa, é o fator primário na determinação de seu comportamento de ligação química. Na tabela periódica, os elementos são listados em ordem crescente de número atômico Z.
É o princípio de exclusão de Pauli que exige que os elétrons de um átomo ocupem diferentes níveis de energia, em vez de todos se condensarem no estado fundamental. A ordenação dos elétrons no estado fundamental de átomos multieletrônicos começa com o estado de energia mais baixo (estado fundamental) e se move progressivamente a partir daí na escala de energia até que cada um dos elétrons do átomo receba um conjunto único de números quânticos. Este fato tem implicações importantes para a construção da tabela periódica dos elementos.
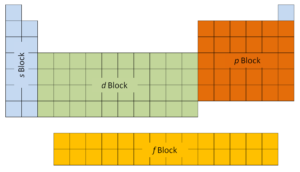 As duas primeiras colunas do lado esquerdo da tabela periódica são onde os subníveis s estão sendo ocupados. Por causa disso, as duas primeiras linhas da tabela periódica são rotuladas como o bloco s. Da mesma forma, o bloco p são as seis colunas mais à direita da tabela periódica, o bloco d são as 10 colunas intermediárias da tabela periódica, enquanto o bloco f é a seção de 14 colunas que normalmente é descrita como separada do corpo principal da tabela periódica. Poderia ser parte do corpo principal, mas então a tabela periódica seria bastante longa e complicada.
As duas primeiras colunas do lado esquerdo da tabela periódica são onde os subníveis s estão sendo ocupados. Por causa disso, as duas primeiras linhas da tabela periódica são rotuladas como o bloco s. Da mesma forma, o bloco p são as seis colunas mais à direita da tabela periódica, o bloco d são as 10 colunas intermediárias da tabela periódica, enquanto o bloco f é a seção de 14 colunas que normalmente é descrita como separada do corpo principal da tabela periódica. Poderia ser parte do corpo principal, mas então a tabela periódica seria bastante longa e complicada.
Para átomos com muitos elétrons, essa notação pode se tornar extensa e, portanto, uma notação abreviada é usada. A configuração eletrônica pode ser visualizada como os elétrons do núcleo, equivalentes ao gás nobre do período anterior, e os elétrons de valência (por exemplo, [Xe] 6s2 para o bário).
Estados de Oxidação
Os estados de oxidação são tipicamente representados por números inteiros que podem ser positivos, zero ou negativos. A maioria dos elementos tem mais de um estado de oxidação possível. Por exemplo, o carbono tem nove possíveis estados inteiros de oxidação de -4 a +4.
A definição atual do IUPAC Gold Book de estado de oxidação é:
“O estado de oxidação de um átomo é a carga desse átomo após a aproximação iônica de suas ligações heteronucleares…”
e o termo número de oxidação é quase sinônimo. Um elemento que não é combinado com nenhum outro elemento diferente tem um estado de oxidação de 0. O estado de oxidação 0 ocorre para todos os elementos – é simplesmente o elemento em sua forma elementar. Um átomo de um elemento em um composto terá um estado de oxidação positivo se tiver seus elétrons removidos. Da mesma forma, a adição de elétrons resulta em um estado de oxidação negativo. Também distinguimos entre os estados de oxidação possíveis e comuns de cada elemento. Por exemplo, o silício tem nove possíveis estados inteiros de oxidação de -4 a +4, mas apenas -4, 0 e +4 são estados de oxidação comuns.
Resumo
| Elemento |
Fósforo |
| Número de prótons |
15 |
| Número de nêutrons (isótopos típicos) |
31 |
| Número de elétrons |
15 |
| configuração eletrônica |
[Ne] 3s2 3p3 |
| Estados de oxidação |
+3,5/-3 |

Fonte: www.luciteria.com
Propriedades de outros elementos
Outras propriedades do Fósforo
 O Fósforo é um elemento químico com número atômico 15, o que significa que existem 15 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.
O Fósforo é um elemento químico com número atômico 15, o que significa que existem 15 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.