icon : info-circle
Le béryllium est un métal dur et grisâtre naturellement présent dans les roches minérales, le charbon, le sol et la poussière volcanique.
Le béryllium a une grande section efficace de diffusion pour les neutrons de haute énergie, environ 6 granges pour les énergies supérieures à environ 10 keV. Par conséquent, il fonctionne comme un réflecteur de neutrons et un modérateur de neutrons, ralentissant efficacement les neutrons à l’énergie thermique. Étant donné que le bérylium a une énergie de seuil très faible pour l’émission de neutrons, il peut être utilisé comme source de neutrons dans les réacteurs nucléaires. La source Sb-Be est basée sur la réaction (γ,n) (c’est-à-dire qu’elle émet des photoneutrons). La teneur en béryllium de la croûte terrestre est de 2,6 ppm. C’est l’un des éléments les plus toxiques, causant ainsi des dommages aux poumons humains et à d’autres organismes. On le trouve dans pas moins de 30 minéraux différents.
Le béryllium est le plus souvent extrait du béryl minéral, qui est soit fritté à l’aide d’un agent d’extraction, soit fondu dans un mélange soluble.
icon : plus-circle
Protons et neutrons dans le Béryllium
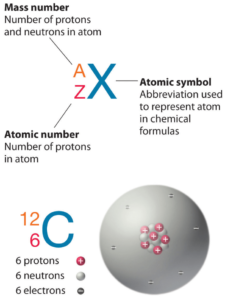 Le béryllium est un élément chimique de numéro atomique 4, ce qui signifie qu’il y a 4 protons dans son noyau. Le nombre total de protons dans le noyau est appelé le numéro atomique de l’atome et reçoit le symbole Z. La charge électrique totale du noyau est donc +Ze, où e (charge élémentaire) vaut 1 602 x 10-19 coulombs.
Le béryllium est un élément chimique de numéro atomique 4, ce qui signifie qu’il y a 4 protons dans son noyau. Le nombre total de protons dans le noyau est appelé le numéro atomique de l’atome et reçoit le symbole Z. La charge électrique totale du noyau est donc +Ze, où e (charge élémentaire) vaut 1 602 x 10-19 coulombs.
Le nombre total de neutrons dans le noyau d’un atome est appelé le nombre de neutrons de l’atome et reçoit le symbole N. Le nombre de neutrons plus le numéro atomique est égal au nombre de masse atomique: N+Z=A . La différence entre le nombre de neutrons et le numéro atomique est appelée excès de neutrons: D = N – Z = A – 2Z.
Pour les éléments stables, il existe généralement une variété d’isotopes stables. Les isotopes sont des nucléides qui ont le même numéro atomique et sont donc le même élément, mais diffèrent par le nombre de neutrons. Le nombre de masse des isotopes typiques du béryllium est de 9.
Principaux isotopes du Béryllium
Le béryllium (4Be) a 12 isotopes connus, mais un seul de ces isotopes (9Be) est stable et un nucléide primordial. En tant que tel, le béryllium est considéré comme un élément monoisotopique. Le béryllium naturel, à l’exception d’une légère contamination par les radio-isotopes cosmogéniques, est du béryllium-9 isotopiquement pur, qui a un spin nucléaire de 3/2. Le béryllium est unique en ce qu’il est le seul élément monoisotopique avec à la fois un nombre pair de protons et un nombre impair de neutrons.
Isotopes stables
[/ su_panel]
[/ su_shadow]
Isotopes instables typiques
[/ su_panel]
[/ su_shadow]
icon : réagir
Électrons et configuration électronique
Le nombre d’électrons dans un atome électriquement neutre est le même que le nombre de protons dans le noyau. Par conséquent, le nombre d’électrons dans l’atome neutre du béryllium est de 4. Chaque électron est influencé par les champs électriques produits par la charge nucléaire positive et les autres (Z – 1) électrons négatifs de l’atome.
Puisque le nombre d’électrons et leur disposition sont responsables du comportement chimique des atomes, le numéro atomique identifie les différents éléments chimiques. La configuration de ces électrons découle des principes de la mécanique quantique. Le nombre d’électrons dans les couches d’électrons de chaque élément, en particulier la couche de valence la plus externe, est le principal facteur déterminant son comportement de liaison chimique. Dans le tableau périodique, les éléments sont classés par ordre croissant de numéro atomique Z.
La configuration électronique du béryllium est [He] 2s2.
Les états d’oxydation possibles sont +1; +2.
Le béryllium réagit avec les acides et avec l’eau pour former de l’hydrogène gazeux. Il réagit brièvement avec l’oxygène de l’air pour former de l’oxyde de béryllium (BeO). L’ oxyde de béryllium forme une fine peau à la surface du métal qui empêche le métal de réagir davantage avec l’oxygène.
Un atome de béryllium a la configuration électronique [He] 2s2. L’état d’oxydation prédominant du béryllium est +2; l’atome de béryllium a perdu ses deux électrons de valence. Des états d’oxydation inférieurs ont été trouvés, par exemple, dans des composés bis (carbène). Le comportement chimique du béryllium est en grande partie le résultat de ses petits rayons atomiques et ioniques. Il a donc des potentiels d’ionisation très élevés et une forte polarisation lorsqu’il est lié à d’autres atomes, c’est pourquoi tous ses composés sont covalents.
icon : nextcloud
Composé le plus courant de Béryllium
Le cuivre au béryllium, également connu sous le nom de bronze au béryllium, est un alliage de cuivre contenant 0,5 à 3 % de béryllium. Le cuivre au béryllium est le plus dur et le plus résistant de tous les alliages de cuivre (UTS jusqu’à 1 400 MPa), à l’état entièrement traité thermiquement et travaillé à froid. Il combine une résistance élevée avec des qualités non magnétiques et anti-étincelles et ses propriétés mécaniques sont similaires à celles de nombreux aciers alliés à haute résistance mais, par rapport aux aciers, il a une meilleure résistance à la corrosion (similaire au cuivre pur).
À propos des protons
 Un proton est l’une des particules subatomiques qui composent la matière. Dans l’univers, les protons sont abondants, constituant environ la moitié de toute la matière visible. Il a une charge électrique positive (+1e) et une masse au repos égale à 1,67262 × 10−27 kg (938,272 MeV/c2) — légèrement plus léger que celui du neutron mais près de 1836 fois supérieur à celui de l’électron. Le proton a un rayon carré moyen d’environ 0,87 × 10−15 m, ou 0,87 fm, et c’est un spin – ½ fermion.
Un proton est l’une des particules subatomiques qui composent la matière. Dans l’univers, les protons sont abondants, constituant environ la moitié de toute la matière visible. Il a une charge électrique positive (+1e) et une masse au repos égale à 1,67262 × 10−27 kg (938,272 MeV/c2) — légèrement plus léger que celui du neutron mais près de 1836 fois supérieur à celui de l’électron. Le proton a un rayon carré moyen d’environ 0,87 × 10−15 m, ou 0,87 fm, et c’est un spin – ½ fermion.
Les protons existent dans les noyaux des atomes typiques, avec leurs homologues neutres, les neutrons. Les neutrons et les protons, communément appelés nucléons, sont liés ensemble dans le noyau atomique, où ils représentent 99,9 % de la masse de l’atome. Les recherches en physique des particules de haute énergie au XXe siècle ont révélé que ni le neutron ni le proton ne sont le plus petit élément constitutif de la matière.
À propos des neutrons
Un neutron est l’une des particules subatomiques qui composent la matière. Dans l’univers, les neutrons sont abondants, constituant plus de la moitié de toute la matière visible. Il n’a pas de charge électrique et une masse au repos égale à 1,67493 × 10−27 kg – légèrement supérieure à celle du proton mais près de 1839 fois supérieure à celle de l’électron. Le neutron a un rayon carré moyen d’environ 0,8 × 10−15 m, ou 0,8 fm, et c’est un fermion de spin ½.
Les noyaux atomiques sont constitués de protons et de neutrons, qui s’attirent par la force nucléaire, tandis que les protons se repoussent par la force électrique en raison de leur charge positive. Ces deux forces entrent en compétition, conduisant à diverses stabilités des noyaux. Il n’y a que certaines combinaisons de neutrons et de protons, qui forment des noyaux stables.
Les neutrons stabilisent le noyau, car ils s’attirent ainsi que les protons, ce qui permet de compenser la répulsion électrique entre les protons. En conséquence, à mesure que le nombre de protons augmente, un rapport croissant de neutrons sur protons est nécessaire pour former un noyau stable. S’il y a trop ou trop peu de neutrons pour un nombre donné de protons, le noyau résultant n’est pas stable et il subit une désintégration radioactive. Les isotopes instables se désintègrent par diverses voies de désintégration radioactive, le plus souvent la désintégration alpha, la désintégration bêta ou la capture d’électrons. De nombreux autres types de désintégration rares, tels que la fission spontanée ou l’émission de neutrons, sont connus. Il convient de noter que toutes ces voies de désintégration peuvent s’accompagner de l’émission subséquente de rayonnement gamma. Les désintégrations alpha ou bêta pures sont très rares.
À propos des électrons et de la configuration des électrons
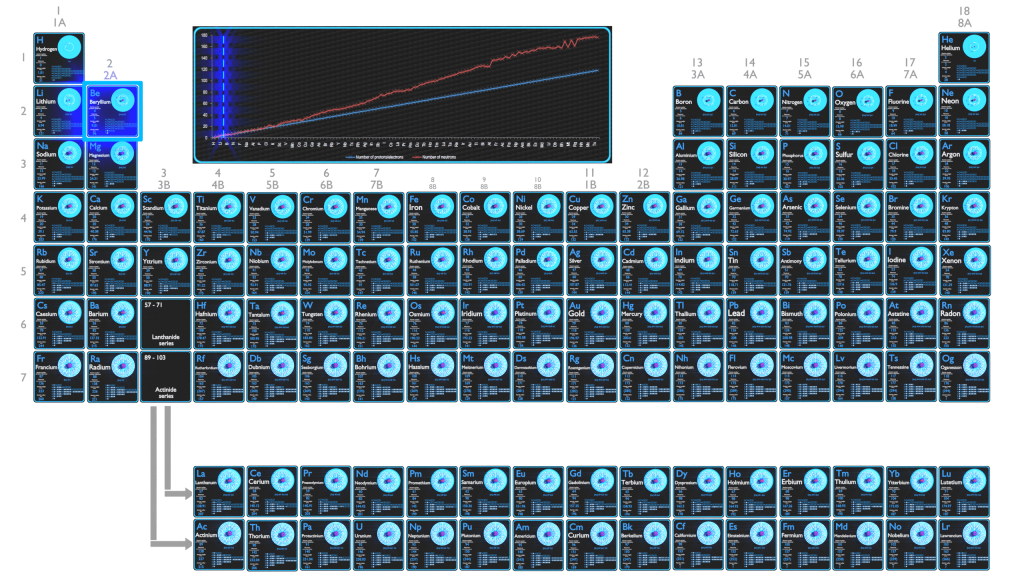
Le tableau périodique est un affichage tabulaire des éléments chimiques organisés en fonction de leurs numéros atomiques, de leurs configurations électroniques et de leurs propriétés chimiques. La configuration électronique est la distribution des électrons d’un atome ou d’une molécule (ou d’une autre structure physique) dans des orbitales atomiques ou moléculaires. La connaissance de la configuration électronique des différents atomes est utile pour comprendre la structure du tableau périodique des éléments.
Chaque solide, liquide, gaz et plasma est composé d’atomes neutres ou ionisés. Les propriétés chimiques de l’atome sont déterminées par le nombre de protons, en fait, par le nombre et la disposition des électrons. La configuration de ces électrons découle des principes de la mécanique quantique. Le nombre d’électrons dans les couches d’électrons de chaque élément, en particulier la couche de valence la plus externe, est le principal facteur déterminant son comportement de liaison chimique. Dans le tableau périodique, les éléments sont classés par ordre croissant de numéro atomique Z.
C’est le principe d’exclusion de Pauli qui exige que les électrons d’un atome occupent différents niveaux d’énergie au lieu qu’ils se condensent tous dans l’état fondamental. L’ordre des électrons dans l’état fondamental des atomes multiélectrons commence par l’état d’énergie le plus bas (état fondamental) et se déplace progressivement de là vers le haut de l’échelle d’énergie jusqu’à ce que chacun des électrons de l’atome se soit vu attribuer un ensemble unique de nombres quantiques. Ce fait a des implications essentielles pour la construction du tableau périodique des éléments.
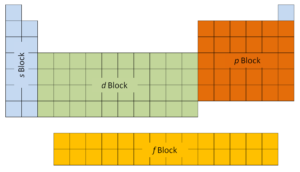 Les deux premières colonnes sur le côté gauche du tableau périodique sont celles où les sous-couches s sont occupées. Pour cette raison, les deux premières lignes du tableau périodique sont étiquetées le bloc s. De même, le bloc p sont les six colonnes les plus à droite du tableau périodique, le bloc d est les 10 colonnes du milieu du tableau périodique, tandis que le bloc f est la section de 14 colonnes qui est normalement représentée comme détachée du corps principal. du tableau périodique. Il pourrait faire partie du corps principal, mais alors le tableau périodique serait plutôt long et encombrant.
Les deux premières colonnes sur le côté gauche du tableau périodique sont celles où les sous-couches s sont occupées. Pour cette raison, les deux premières lignes du tableau périodique sont étiquetées le bloc s. De même, le bloc p sont les six colonnes les plus à droite du tableau périodique, le bloc d est les 10 colonnes du milieu du tableau périodique, tandis que le bloc f est la section de 14 colonnes qui est normalement représentée comme détachée du corps principal. du tableau périodique. Il pourrait faire partie du corps principal, mais alors le tableau périodique serait plutôt long et encombrant.
Pour les atomes avec de nombreux électrons, cette notation peut devenir longue et donc une notation abrégée est utilisée. La configuration électronique peut être visualisée comme les électrons de cœur, équivalents au gaz noble de la période précédente, et les électrons de valence (par exemple [Xe] 6s2 pour le baryum).
États d’oxydation
Les états d’oxydation sont généralement représentés par des nombres entiers qui peuvent être positifs, nuls ou négatifs. La plupart des éléments ont plus d’un état d’oxydation possible. Par exemple, le carbone a neuf états d’oxydation entiers possibles de -4 à +4.
La définition actuelle de l’état d’oxydation du livre d’or IUPAC est:
« L’état d’oxydation d’un atome est la charge de cet atome après approximation ionique de ses liaisons hétéronucléaires… »
et le terme nombre d’oxydation est presque synonyme. Un élément qui n’est combiné à aucun autre élément différent a un état d’oxydation de 0. L’état d’oxydation 0 se produit pour tous les éléments – c’est simplement l’élément sous sa forme élémentaire. Un atome d’un élément dans un composé aura un état d’oxydation positif s’il a eu des électrons retirés. De même, l’ajout d’électrons entraîne un état d’oxydation négatif. Nous avons également distingué les états d’oxydation possibles et communs de chaque élément. Par exemple, le silicium a neuf états d’oxydation entiers possibles de -4 à +4, mais seuls -4, 0 et +4 sont des états d’oxydation communs.
Résumé
| Élément |
Béryllium |
| Nombre de protons |
4 |
| Nombre de neutrons (isotopes typiques) |
9 |
| Nombre d’électrons |
4 |
| Configuration électronique |
[Il] 2s2 |
| États d’oxydation |
+1; +2 |

Source : www.luciteria.com
Propriétés des autres éléments
Autres propriétés du Béryllium
 Le béryllium est un élément chimique de numéro atomique 4, ce qui signifie qu’il y a 4 protons dans son noyau. Le nombre total de protons dans le noyau est appelé le numéro atomique de l’atome et reçoit le symbole Z. La charge électrique totale du noyau est donc +Ze, où e (charge élémentaire) vaut 1 602 x 10-19 coulombs.
Le béryllium est un élément chimique de numéro atomique 4, ce qui signifie qu’il y a 4 protons dans son noyau. Le nombre total de protons dans le noyau est appelé le numéro atomique de l’atome et reçoit le symbole Z. La charge électrique totale du noyau est donc +Ze, où e (charge élémentaire) vaut 1 602 x 10-19 coulombs.