Le carbone est non métallique et tétravalent, ce qui rend quatre électrons disponibles pour former des liaisons chimiques covalentes. Le carbone est l’un des rares éléments connus depuis l’Antiquité.
La principale utilisation économique du carbone autre que la nourriture et le bois se présente sous la forme d’hydrocarbures, notamment le gaz méthane et le pétrole brut (pétrole). Le graphite et les diamants sont deux allotropes importants du carbone qui ont de nombreuses applications. Les utilisations du carbone et de ses composés sont extrêmement variées.
Le graphite, le diamant et d’autres formes de carbone sont directement extraits des mines.
Protons et neutrons dans le Carbone
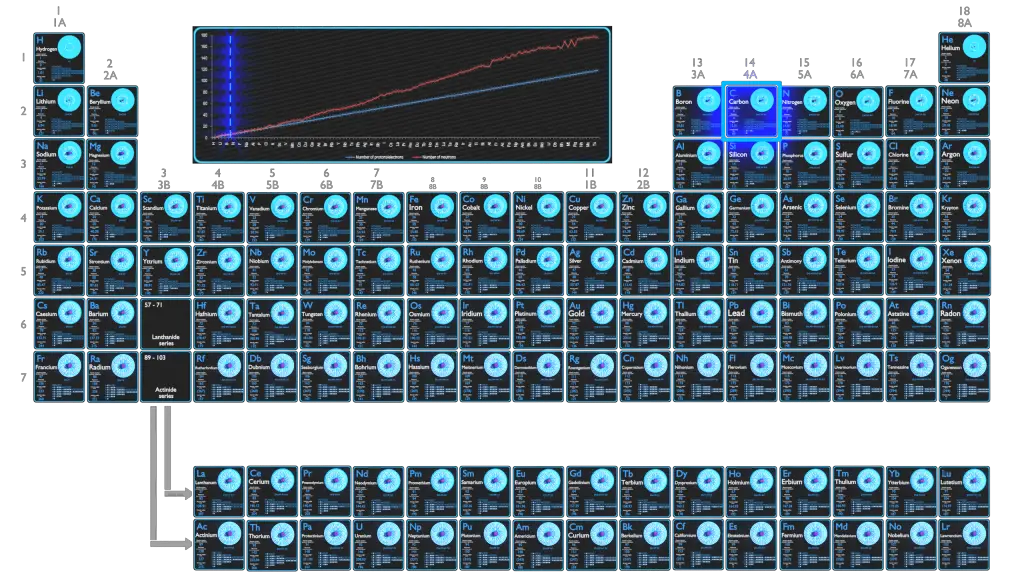
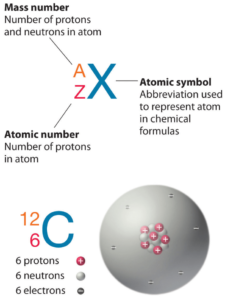 Le carbone est un élément chimique de numéro atomique 6, ce qui signifie qu’il y a 6 protons dans son noyau. Le nombre total de protons dans le noyau est appelé le numéro atomique de l’atome et reçoit le symbole Z. La charge électrique totale du noyau est donc +Ze, où e (charge élémentaire) vaut 1 602 x 10-19 coulombs.
Le carbone est un élément chimique de numéro atomique 6, ce qui signifie qu’il y a 6 protons dans son noyau. Le nombre total de protons dans le noyau est appelé le numéro atomique de l’atome et reçoit le symbole Z. La charge électrique totale du noyau est donc +Ze, où e (charge élémentaire) vaut 1 602 x 10-19 coulombs.
Le nombre total de neutrons dans le noyau d’un atome est appelé le nombre de neutrons de l’atome et reçoit le symbole N. Le nombre de neutrons plus le numéro atomique est égal au nombre de masse atomique: N+Z=A . La différence entre le nombre de neutrons et le numéro atomique est appelée excès de neutrons: D = N – Z = A – 2Z.
Pour les éléments stables, il existe généralement une variété d’isotopes stables. Les isotopes sont des nucléides qui ont le même numéro atomique et sont donc le même élément, mais diffèrent par le nombre de neutrons. Les nombres de masse des isotopes typiques du carbone sont de 12; 13.
Principaux isotopes du Carbone
Le carbone a 15 isotopes connus, du 8C au 22C, dont 12C et 13C sont stables. Le radio-isotope ayant la plus longue durée de vie est le 14C, avec une demi-vie de 5 730 ans.
Le carbone 12 est le plus abondant des deux isotopes stables du carbone (le carbone 13 étant l’autre), représentant 98,93 % de l’élément carbone. Le carbone 12 revêt une importance particulière dans son utilisation comme étalon à partir duquel les masses atomiques de tous les nucléides sont mesurées, ainsi, sa masse atomique est exactement de 12 daltons par définition. Le carbone 12 est composé de 6 protons, 6 neutrons et 6 électrons.
Le carbone 13 est un isotope naturel et stable du carbone avec un noyau contenant six protons et sept neutrons. En tant que l’un des isotopes environnementaux, il représente environ 1,1 % de tout le carbone naturel sur Terre.
Le seul radionucléide cosmogénique à apporter une contribution significative à l’exposition interne de l’homme est le carbone 14. Le carbone 14 radioactif a une demi-vie de 5730 ans et subit une désintégration β−, où le neutron est converti en un proton, un électron et un antineutrino électronique. Le carbone 14 peut également être produit dans l’atmosphère par d’autres réactions neutroniques, dont notamment le 13C(n,γ)14C et le 17O(n,α)14C. En conséquence, le carbone 14 se forme en continu dans la haute atmosphère par l’interaction des rayons cosmiques avec l’azote atmosphérique. En moyenne, un seul sur 1,3 x 10 12 atomes de carbone dans l’atmosphère est un atome radioactif de carbone 14. Ainsi, toutes les substances biologiques vivantes contiennent la même quantité de C-14 par gramme de carbone, soit 0,3 Bq d’activité carbone-14 par gramme de carbone.
Isotopes instables typiques
| Isotope | Demi-vie | Mode de décomposition | Produit |
| 11C | 20 min | désintégration bêta positive | 11B |
| 14C | 5730 a | désintégration bêta | 14N |
Électrons et configuration électronique
Le nombre d’électrons dans un atome électriquement neutre est le même que le nombre de protons dans le noyau. Par conséquent, le nombre d’électrons dans l’atome neutre de carbone est de 6. Chaque électron est influencé par les champs électriques produits par la charge nucléaire positive et les autres électrons négatifs (Z – 1) dans l’atome.
Puisque le nombre d’électrons et leur disposition sont responsables du comportement chimique des atomes, le numéro atomique identifie les différents éléments chimiques. La configuration de ces électrons découle des principes de la mécanique quantique. Le nombre d’électrons dans les couches d’électrons de chaque élément, en particulier la couche de valence la plus externe, est le principal facteur déterminant son comportement de liaison chimique. Dans le tableau périodique, les éléments sont classés par ordre croissant de numéro atomique Z.
La configuration électronique du carbone est [He] 2s2 2p2.
Les états d’oxydation possibles sont -4; -3 …; + 4.
Le carbone est connu pour former près de dix millions de composés, une grande majorité de tous les composés chimiques. C’est un élément tétravalent typique – rendant quatre électrons disponibles pour former des liaisons chimiques covalentes. Le carbone est présent dans toute vie organique connue et constitue la base de la chimie organique. Lorsqu’il est associé à l’hydrogène, il forme divers hydrocarbures qui sont importants pour l’industrie comme réfrigérants, lubrifiants, solvants, comme matière première chimique pour la fabrication de plastiques et de produits pétrochimiques, et comme combustibles fossiles.
Composé chimique de Carbone le plus courant
Les molécules de dioxyde de carbone sont constituées d’un atome de carbone lié par covalence à deux atomes d’oxygène. Le dioxyde de carbone est un gaz incolore dont la densité est supérieure d’environ 53 % à celle de l’air sec. Il est relativement non toxique et incombustible, mais il est plus lourd que l’air et peut s’asphyxier par déplacement d’air. Lorsque le CO2 est dissous dans l’eau, l’acide carbonique doux se forme. Le CO2 refroidi sous forme solide est appelé neige carbonique. Le dioxyde de carbone est un composant mineur de l’atmosphère terrestre mais un constituant important de l’air. C’est une matière première nécessaire à la plupart des végétaux, qui éliminent le dioxyde de carbone de l’air en utilisant le processus de photosynthèse. Une concentration typique de CO2 dans l’air est actuellement d’environ 0,040 % ou 404 ppm. La concentration de dioxyde de carbone atmosphérique augmente et diminue selon un schéma saisonnier sur une plage d’environ 6 ppmv. La concentration de CO2 dans l’air augmente également régulièrement d’année en année depuis plus de 70 ans. Le taux d’augmentation actuel est d’environ 2,5 ppm par an.
Résumé
| Élément | Carbone |
| Nombre de protons | 6 |
| Nombre de neutrons (isotopes typiques) | 12; 13 |
| Nombre d’électrons | 6 |
| Configuration électronique | [Il] 2s2 2p2 |
| États d’oxydation | -4; -3 …; + 4 |
Source : www.luciteria.com