O Carbono é não metálico e tetravalente, disponibilizando quatro elétrons para formar ligações químicas covalentes. O Carbono é um dos poucos elementos conhecidos desde a antiguidade.
O principal uso econômico do carbono, além de alimentos e madeira, está na forma de hidrocarbonetos, principalmente o gás metano de combustível fóssil e o petróleo bruto (petróleo). Grafite e diamantes são dois importantes alótropos de carbono que têm amplas aplicações. Os usos do carbono e seus compostos são extremamente variados.
Grafite, diamante e outras formas de carbono são obtidos diretamente das minas.
Prótons e nêutrons no Carbono
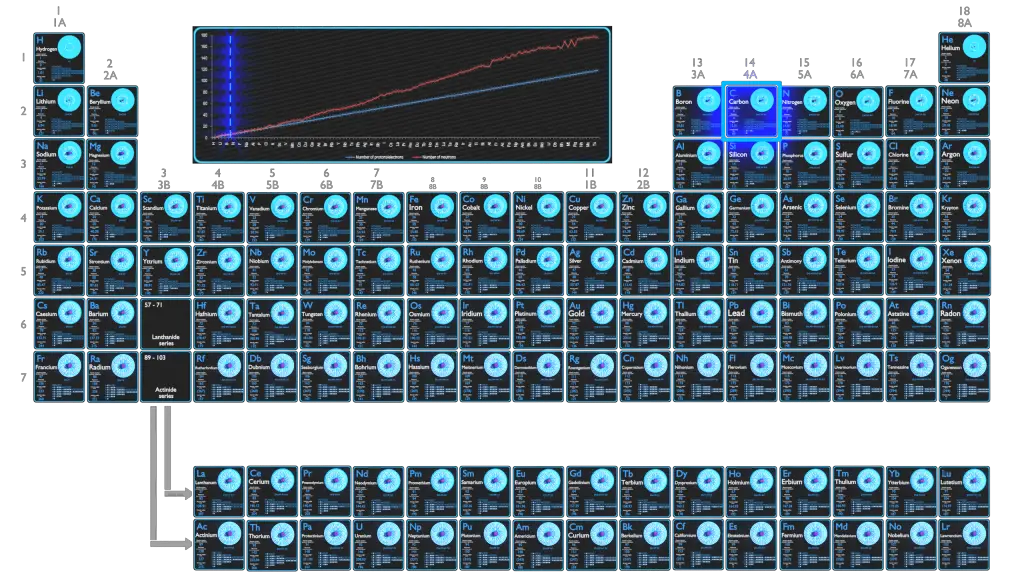
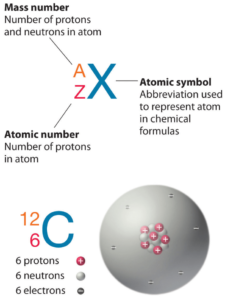 O Carbono é um elemento químico com número atômico 6, o que significa que existem 6 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.
O Carbono é um elemento químico com número atômico 6, o que significa que existem 6 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.
O número total de nêutrons no núcleo de um átomo é chamado de número de nêutrons do átomo e recebe o símbolo N. O número de nêutrons mais o número atômico é igual ao número de massa atômica: N+Z=A. A diferença entre o número de nêutrons e o número atômico é conhecida como excesso de nêutrons: D = N – Z = A – 2Z.
Para elementos estáveis, geralmente há uma variedade de isótopos estáveis. Isótopos são nuclídeos que possuem o mesmo número atômico e, portanto, são o mesmo elemento, mas diferem no número de nêutrons. Os números de massa dos isótopos típicos do Carbono são 12; 13.
Principais isótopos de Carbono
O Carbono possui 15 isótopos conhecidos, de 8C a 22C, dos quais 12C e 13C são estáveis. O radioisótopo de vida mais longa é o 14C, com meia-vida de 5,730 anos.
O Carbono-12 é o mais abundante dos dois isótopos estáveis do Carbono (sendo o carbono-13 o outro), totalizando 98,93% do elemento carbono. O Carbono-12 é de particular importância em seu uso como padrão a partir do qual as massas atômicas de todos os nuclídeos são medidas, portanto, sua massa atômica é exatamente 12 daltons por definição. O Carbono-12 é composto por 6 prótons, 6 nêutrons e 6 elétrons.
O Carbono-13 é um isótopo natural e estável do Carbono com um núcleo contendo seis prótons e sete nêutrons. Como um dos isótopos ambientais, representa cerca de 1,1% de todo o carbono natural da Terra.
O único radionuclídeo cosmogênico a contribuir significativamente para a exposição interna do ser humano é o Carbono-14. O Carbono-14 radioativo tem uma meia-vida de 5,730 anos e sofre decaimento β-, onde o nêutron é convertido em um próton, um elétron e um antineutrino de elétron. O carbono-14 também pode ser produzido na atmosfera por outras reações de nêutrons, incluindo em particular 13C(n,γ)14C e 17O(n,α)14C. Como resultado, o carbono-14 é continuamente formado na atmosfera superior pela interação dos raios cósmicos com o nitrogênio atmosférico. Em média, apenas um em cada 1,3 x 1012 átomos de carbono na atmosfera é um átomo de carbono-14 radioativo. Como resultado, todas as substâncias biológicas vivas contêm a mesma quantidade de C-14 por grama de carbono, ou seja, 0,3 Bq de atividade de carbono-14 por grama de carbono.
Isótopos Estáveis
| Isótopo | Abundância | número de nêutrons |
| 12C | 98,9 | 6 |
| 13C | 1,1 | 7 |
Isótopos Instáveis Típicos
| Isótopo | Meia-vida | Modo Decaimento | produtos |
| 11C | 20 min | decaimento beta positivo | 11B |
| 14C | 5730 a | decaimento beta | 14N |
Elétrons e configuração eletrônica
O número de elétrons em um átomo eletricamente neutro é o mesmo que o número de prótons no núcleo. Portanto, o número de elétrons no átomo neutro de Carbono é 6. Cada elétron é influenciado pelos campos elétricos produzidos pela carga nuclear positiva e os outros (Z – 1) elétrons negativos no átomo.
Como o número de elétrons e seu arranjo são responsáveis pelo comportamento químico dos átomos, o número atômico identifica os vários elementos químicos. A configuração desses elétrons segue os princípios da mecânica quântica. O número de elétrons nas camadas de elétrons de cada elemento, particularmente na camada de valência mais externa, é o fator primário na determinação de seu comportamento de ligação química. Na tabela periódica, os elementos são listados em ordem crescente de número atômico Z.
A configuração eletrônica do Carbono é [He] 2s2 2p2.
Os possíveis estados de oxidação são -4; -3…; +4.
Sabe-se que o carbono forma quase dez milhões de compostos, a grande maioria de todos os compostos químicos. É um elemento tetravalente típico — disponibilizando quatro elétrons para formar ligações químicas covalentes. O Carbono ocorre em toda a vida orgânica conhecida e é a base da química orgânica. Quando unido ao hidrogênio, forma vários hidrocarbonetos importantes para a indústria como refrigerantes, lubrificantes, solventes, como matéria-prima química para a fabricação de plásticos e petroquímicos e como combustíveis fósseis.
Composto Químico Mais Comum de Carbono
As moléculas de dióxido de Carbono consistem em um átomo de carbono ligado covalentemente a dois átomos de oxigênio. O dióxido de Carbono é um gás incolor com densidade cerca de 53% maior que a do ar seco. É relativamente atóxico e incombustível, mas é mais pesado que o ar e pode asfixiar pelo deslocamento do ar. Quando o CO2 é dissolvido em água, o ácido carbônico suave é formado. O CO2 resfriado na forma sólida é chamado de gelo seco. O dióxido de Carbono é um componente menor da atmosfera da Terra, mas constituinte importante do ar. É uma matéria-prima necessária para a maioria das plantas, que removem o dióxido de Carbono do ar usando o processo de fotossíntese. Uma concentração típica de CO2 no ar é atualmente cerca de 0,040% ou 404 ppm. A concentração de dióxido de carbono atmosférico aumenta e diminui em um padrão sazonal em uma faixa de cerca de 6 ppmv. A concentração de CO2 no ar também tem aumentado de ano para ano por mais de 70 anos. A taxa atual de aumento é de cerca de 2,5 ppm por ano.
Resumo
| Elemento | Carbono |
| Número de prótons | 6 |
| Número de nêutrons (isótopos típicos) | 12; 13 |
| Número de elétrons | 6 |
| configuração eletrônica | [Ele] 2s2 2p2 |
| Estados de oxidação | -4; -3…; +4 |
Fonte: www.luciteria.com