O Berílio é um metal duro e acinzentado encontrado naturalmente em rochas minerais, carvão, solo e poeira vulcânica.
O Berílio tem uma grande seção transversal de espalhamento para nêutrons de alta energia, cerca de 6 celeiros para energias acima de aproximadamente 10 keV. Portanto, funciona como um refletor de nêutrons e moderador de nêutrons, reduzindo efetivamente os nêutrons à energia térmica. Como o Berílio tem um limiar de energia muito baixo para emissão de nêutrons, ele pode ser usado como fonte de nêutrons em reatores nucleares. A fonte Sb-Be é baseada na reação (γ,n) (isto é, emite fotonêutrons). O teor de Berílio na crosta terrestre é de 2,6 ppm. É um dos elementos mais tóxicos, portanto, causa danos aos pulmões humanos e outros organismos. É encontrado em até 30 minerais diferentes.
O Berílio é mais comumente extraído do mineral Berilo, que é sinterizado usando um agente de extração ou fundido em uma mistura solúvel.
Prótons e nêutrons no Berílio
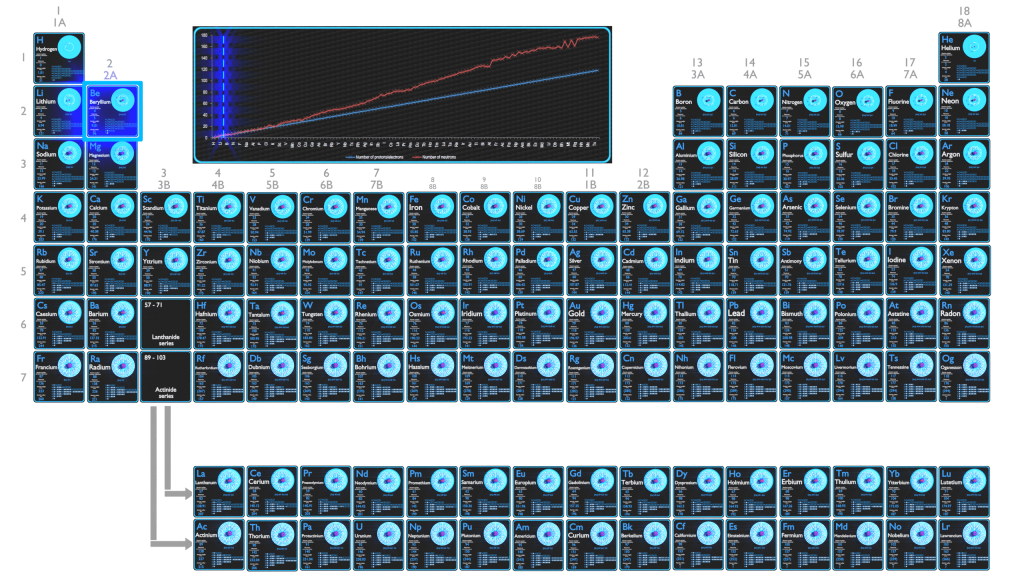
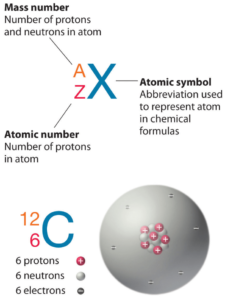 O Berílio é um elemento químico com número atômico 4, o que significa que existem 4 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.
O Berílio é um elemento químico com número atômico 4, o que significa que existem 4 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.
O número total de nêutrons no núcleo de um átomo é chamado de número de nêutrons do átomo e recebe o símbolo N. O número de nêutrons mais o número atômico é igual ao número de massa atômica: N+Z=A. A diferença entre o número de nêutrons e o número atômico é conhecida como excesso de nêutrons: D = N – Z = A – 2Z.
Para elementos estáveis, geralmente há uma variedade de isótopos estáveis. Isótopos são nuclídeos que possuem o mesmo número atômico e, portanto, são o mesmo elemento, mas diferem no número de nêutrons. Números de massa de isótopos típicos de Berílio é 9.
Principais isótopos de Berílio
O Berílio (4Be) tem 12 isótopos conhecidos, mas apenas um desses isótopos (9Be) é estável e um nuclídeo primordial. Como tal, o Berílio é considerado um elemento monoisotópico. O Berílio que ocorre naturalmente, salvo uma leve contaminação pelos radioisótopos cosmogênicos, é o Berílio-9 isotopicamente puro, que tem um spin nuclear de 3/2. O Berílio é único por ser o único elemento monoisotópico com um número par de prótons e um número ímpar de nêutrons.
Isótopos Instáveis Típicos
Elétrons e configuração eletrônica
O número de elétrons em um átomo eletricamente neutro é o mesmo que o número de prótons no núcleo. Portanto, o número de elétrons no átomo neutro do Berílio é 4. Cada elétron é influenciado pelos campos elétricos produzidos pela carga nuclear positiva e os outros (Z – 1) elétrons negativos no átomo.
Como o número de elétrons e seu arranjo são responsáveis pelo comportamento químico dos átomos, o número atômico identifica os vários elementos químicos. A configuração desses elétrons segue os princípios da mecânica quântica. O número de elétrons nas camadas de elétrons de cada elemento, particularmente na camada de valência mais externa, é o fator primário na determinação de seu comportamento de ligação química. Na tabela periódica, os elementos são listados em ordem crescente de número atômico Z.
A configuração eletrônica do Berílio é [He] 2s2.
Os possíveis estados de oxidação são +1; +2.
O Berílio reage com ácidos e com água para formar gás hidrogênio. Ele reage brevemente com o oxigênio do ar para formar óxido de Berílio (BeO). O óxido de Berílio forma uma película fina na superfície do metal que impede que o metal reaja ainda mais com o oxigênio.
Um átomo de berílio tem a configuração eletrônica [He] 2s2. O estado de oxidação predominante do berílio é +2; o átomo de berílio perdeu seus dois elétrons de valência. Estados de oxidação mais baixos foram encontrados, por exemplo, em compostos bis (carbeno). O comportamento químico do berílio é em grande parte resultado de seus pequenos raios atômicos e iônicos. Assim, possui potenciais de ionização muito altos e forte polarização quando ligado a outros átomos, razão pela qual todos os seus compostos são covalentes.
Composto mais comum de Berílio
O Cobre-Berílio, também conhecido como Bronze-Berílio, é uma liga de cobre com 0,5 a 3% de berílio. O cobre berílio é o mais duro e forte de qualquer liga de cobre (UTS até 1.400 MPa), na condição totalmente tratada termicamente e trabalhada a frio. Combina alta resistência com qualidades não magnéticas e não faiscantes e é semelhante em propriedades mecânicas a muitos aços de liga de alta resistência, mas, em comparação com os aços, possui melhor resistência à corrosão (semelhante ao cobre puro).
Sobre os prótons
 Um próton é uma das partículas subatômicas que compõem a matéria. No universo, os prótons são abundantes, constituindo cerca de metade de toda a matéria visível. Tem uma carga elétrica positiva (+1e) e uma massa de repouso igual a 1,67262 × 10−27 kg (938,272 MeV/c2) — ligeiramente mais leve que a do nêutron, mas quase 1,836 vezes maior que a do elétron. O próton tem um raio quadrado médio de cerca de 0,87 × 10−15 m, ou 0,87 fm, e é um spin – ½ férmion.
Um próton é uma das partículas subatômicas que compõem a matéria. No universo, os prótons são abundantes, constituindo cerca de metade de toda a matéria visível. Tem uma carga elétrica positiva (+1e) e uma massa de repouso igual a 1,67262 × 10−27 kg (938,272 MeV/c2) — ligeiramente mais leve que a do nêutron, mas quase 1,836 vezes maior que a do elétron. O próton tem um raio quadrado médio de cerca de 0,87 × 10−15 m, ou 0,87 fm, e é um spin – ½ férmion.
Os prótons existem nos núcleos de átomos típicos, junto com suas contrapartes neutras, os nêutrons. Nêutrons e prótons, comumente chamados de núcleons, estão unidos no núcleo atômico, onde representam 99,9% da massa do átomo. A pesquisa em física de partículas de alta energia no século 20 revelou que nem o nêutron nem o próto não são o menor bloco de construção da matéria.
Sobre Neutrons
Um nêutron é uma das partículas subatômicas que compõem a matéria. No universo, os nêutrons são abundantes, constituindo mais da metade de toda a matéria visível. Ele não tem carga elétrica e uma massa de repouso igual a 1,67493 × 10−27 kg – ligeiramente maior que a do próton, mas quase 1,839 vezes maior que a do elétron. O nêutron tem um raio quadrado médio de cerca de 0,8 × 10−15 m, ou 0,8 fm, e é um férmion spin-½.
Os núcleos atômicos consistem em prótons e nêutrons, que se atraem através da força nuclear, enquanto os prótons se repelem através da força elétrica devido à sua carga positiva. Essas duas forças competem, levando a várias estabilidades de núcleos. Existem apenas certas combinações de nêutrons e prótons, que formam núcleos estáveis.
Os nêutrons estabilizam o núcleo, pois atraem uns aos outros e os prótons, o que ajuda a compensar a repulsão elétrica entre os prótons. Como resultado, à medida que o número de prótons aumenta, uma proporção crescente de nêutrons para prótons é necessária para formar um núcleo estável. Se houver muitos ou poucos nêutrons para um determinado número de prótons, o núcleo resultante não é estável e sofre decaimento radioativo. Isótopos instáveis decaem através de vários caminhos de decaimento radioativo, mais comumente decaimento alfa, decaimento beta ou captura de elétrons. Muitos outros tipos raros de decaimento, como fissão espontânea ou emissão de nêutrons, são conhecidos. Deve-se notar que todas essas vias de decaimento podem ser acompanhadas pela subsequente emissão de radiação gama. Decaimentos alfa ou beta puros são muito raros.
Sobre elétrons e configuração de elétrons
A tabela periódica é uma exibição tabular dos elementos químicos organizados com base em seus números atômicos, configurações eletrônicas e propriedades químicas. A configuração eletrônica é a distribuição de elétrons de um átomo ou molécula (ou outra estrutura física) em orbitais atômicos ou moleculares. O conhecimento da configuração eletrônica de diferentes átomos é útil para entender a estrutura da tabela periódica dos elementos.
Todo sólido, líquido, gás e plasma é composto de átomos neutros ou ionizados. As propriedades químicas do átomo são determinadas pelo número de prótons, na verdade, pelo número e disposição dos elétrons. A configuração desses elétrons segue os princípios da mecânica quântica. O número de elétrons nas camadas de elétrons de cada elemento, particularmente na camada de valência mais externa, é o fator primário na determinação de seu comportamento de ligação química. Na tabela periódica, os elementos são listados em ordem crescente de número atômico Z.
É o princípio de exclusão de Pauli que exige que os elétrons de um átomo ocupem diferentes níveis de energia, em vez de todos se condensarem no estado fundamental. A ordenação dos elétrons no estado fundamental de átomos multieletrônicos começa com o estado de energia mais baixo (estado fundamental) e se move progressivamente a partir daí na escala de energia até que cada um dos elétrons do átomo receba um conjunto único de números quânticos. Este fato tem implicações importantes para a construção da tabela periódica dos elementos.
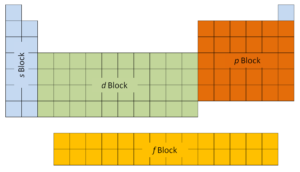 As duas primeiras colunas do lado esquerdo da tabela periódica são onde os subníveis s estão sendo ocupados. Por causa disso, as duas primeiras linhas da tabela periódica são rotuladas como o bloco s. Da mesma forma, o bloco p são as seis colunas mais à direita da tabela periódica, o bloco d são as 10 colunas intermediárias da tabela periódica, enquanto o bloco f é a seção de 14 colunas que normalmente é descrita como separada do corpo principal da tabela periódica. Poderia ser parte do corpo principal, mas então a tabela periódica seria bastante longa e complicada.
As duas primeiras colunas do lado esquerdo da tabela periódica são onde os subníveis s estão sendo ocupados. Por causa disso, as duas primeiras linhas da tabela periódica são rotuladas como o bloco s. Da mesma forma, o bloco p são as seis colunas mais à direita da tabela periódica, o bloco d são as 10 colunas intermediárias da tabela periódica, enquanto o bloco f é a seção de 14 colunas que normalmente é descrita como separada do corpo principal da tabela periódica. Poderia ser parte do corpo principal, mas então a tabela periódica seria bastante longa e complicada.
Para átomos com muitos elétrons, essa notação pode se tornar extensa e, portanto, uma notação abreviada é usada. A configuração eletrônica pode ser visualizada como os elétrons do núcleo, equivalentes ao gás nobre do período anterior, e os elétrons de valência (por exemplo, [Xe] 6s2 para o bário).
Estados de Oxidação
Os estados de oxidação são tipicamente representados por números inteiros que podem ser positivos, zero ou negativos. A maioria dos elementos tem mais de um estado de oxidação possível. Por exemplo, o carbono tem nove possíveis estados inteiros de oxidação de -4 a +4.
A definição atual do IUPAC Gold Book de estado de oxidação é:
“O estado de oxidação de um átomo é a carga desse átomo após a aproximação iônica de suas ligações heteronucleares…”
e o termo número de oxidação é quase sinônimo. Um elemento que não é combinado com nenhum outro elemento diferente tem um estado de oxidação de 0. O estado de oxidação 0 ocorre para todos os elementos – é simplesmente o elemento em sua forma elementar. Um átomo de um elemento em um composto terá um estado de oxidação positivo se tiver seus elétrons removidos. Da mesma forma, a adição de elétrons resulta em um estado de oxidação negativo. Também distinguimos entre os estados de oxidação possíveis e comuns de cada elemento. Por exemplo, o silício tem nove possíveis estados inteiros de oxidação de -4 a +4, mas apenas -4, 0 e +4 são estados de oxidação comuns.
Resumo
| Elemento |
Berílio |
| Número de prótons |
4 |
| Número de nêutrons (isótopos típicos) |
9 |
| Número de elétrons |
4 |
| configuração eletrônica |
[Ele] 2s2 |
| Estados de oxidação |
+1; +2 |

Fonte: www.luciteria.com
Propriedades de outros elementos
Outras propriedades do Berílio
 O Berílio é um elemento químico com número atômico 4, o que significa que existem 4 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.
O Berílio é um elemento químico com número atômico 4, o que significa que existem 4 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.