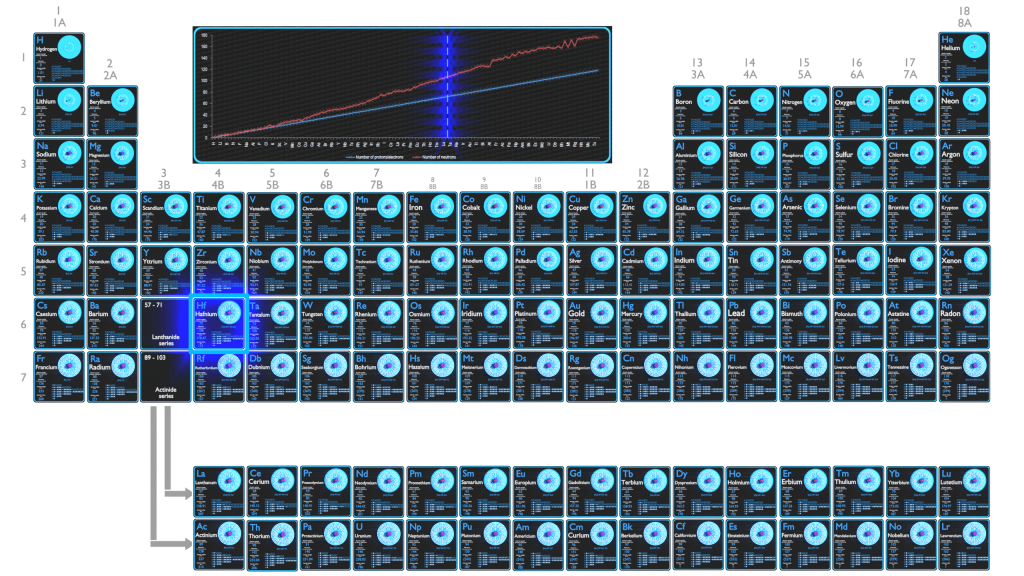
O Háfnio é um metal de transição brilhante, cinza prateado, tetravalente, o háfnio se assemelha quimicamente ao zircônio e é encontrado em muitos minerais de zircônio. A grande seção transversal de captura de nêutrons do háfnio o torna um bom material para absorção de nêutrons em hastes de controle em usinas nucleares, mas ao mesmo tempo requer que ele seja removido das ligas de zircônio transparentes a nêutrons e resistentes à corrosão usadas em reatores nucleares.
Prótons e nêutrons no Háfnio
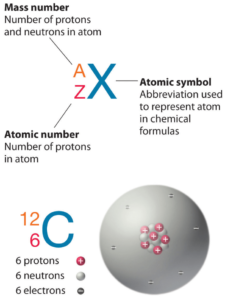 Háfnio é um elemento químico com número atômico 72, o que significa que existem 72 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.
Háfnio é um elemento químico com número atômico 72, o que significa que existem 72 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.
O número total de nêutrons no núcleo de um átomo é chamado de número de nêutrons do átomo e recebe o símbolo N. O número de nêutrons mais o número atômico é igual ao número de massa atômica: N+Z=A. A diferença entre o número de nêutrons e o número atômico é conhecida como excesso de nêutrons: D = N – Z = A – 2Z.
Para elementos estáveis, geralmente há uma variedade de isótopos estáveis. Isótopos são nuclídeos que possuem o mesmo número atômico e, portanto, são o mesmo elemento, mas diferem no número de nêutrons. Números de massa de isótopos típicos de Háfnio são 176-178, 179, 180.
Principais isótopos do Háfnio
Háfnio ocorre em 6 isótopos naturais: 174Hf, 176Hf, 177Hf, 178Hf, 179Hf e 180Hf. 174Hf é levemente radioativo, decaindo por decaimento alfa com uma meia-vida de 2× 1015 anos. 180Hf é o isótopo mais comum, tendo uma abundância natural de aproximadamente 35%.
Háfnio-174 é composto de 72 prótons, 102 nêutrons e 72 elétrons.
Háfnio-176 é composto de 72 prótons, 104 nêutrons e 72 elétrons.
Háfnio-177 é composto de 72 prótons, 105 nêutrons e 72 elétrons.
Háfnio-178 é composto de 72 prótons, 106 nêutrons e 72 elétrons.
Háfnio-179 é composto de 72 prótons, 107 nêutrons e 72 elétrons.
Háfnio-180 é composto de 72 prótons, 108 nêutrons e 72 elétrons.
Isótopos de ocorrência natural
| Isótopo | Abundância | número de nêutrons |
| 174Hf (instável) | 0,16% | 102 |
| 176Hf | 5,26% | 104 |
| 177Hf | 18,60% | 105 |
| 178Hf | 27,28% | 106 |
| 179Hf | 13,62% | 107 |
| 180Hf | 35,08% | 108 |
Isótopos Instáveis Típicos
| Isótopo | Meia-vida | Modo Decaimento | produtos |
| 172Hf | 1,87 a | captura eletrônica | 172Lu |
| 174Hf | 2×1015 a | decaimento alfa | 170Yb |
| 178m2Hf | 31 a | raio gama | 178Hf |
| 182Hf | 8,9 × 106 a | decaimento beta | 182Ta |
Elétrons e configuração eletrônica
O número de elétrons em um átomo eletricamente neutro é o mesmo que o número de prótons no núcleo. Portanto, o número de elétrons no átomo neutro de Háfnio é 72. Cada elétron é influenciado pelos campos elétricos produzidos pela carga nuclear positiva e os outros (Z – 1) elétrons negativos no átomo.
Como o número de elétrons e seu arranjo são responsáveis pelo comportamento químico dos átomos, o número atômico identifica os vários elementos químicos. A configuração desses elétrons segue os princípios da mecânica quântica. O número de elétrons nas camadas de elétrons de cada elemento, particularmente na camada de valência mais externa, é o fator primário na determinação de seu comportamento de ligação química. Na tabela periódica, os elementos são listados em ordem crescente de número atômico Z.
A configuração eletrônica do Háfnio é [Xe] 4f14 5d2 6s2.
Possíveis estados de oxidação são +4.
Composto mais comum de Háfnio
Enquanto o nitreto de háfnio é o mais refratário de todos os nitretos metálicos, o carboneto de Háfnio é o mais refratário de todos os materiais binários. Com um ponto de fusão de cerca de 3900 °C, é um dos compostos binários mais refratários conhecidos. Devido à complexidade técnica e ao alto custo da síntese, o HfC tem um uso muito limitado, apesar de suas propriedades favoráveis, como alta dureza (>9 Mohs) e ponto de fusão.
A tabela periódica é uma exibição tabular dos elementos químicos organizados com base em seus números atômicos, configurações eletrônicas e propriedades químicas. A configuração eletrônica é a distribuição de elétrons de um átomo ou molécula (ou outra estrutura física) em orbitais atômicos ou moleculares. O conhecimento da configuração eletrônica de diferentes átomos é útil para entender a estrutura da tabela periódica dos elementos.
Todo sólido, líquido, gás e plasma é composto de átomos neutros ou ionizados. As propriedades químicas do átomo são determinadas pelo número de prótons, na verdade, pelo número e disposição dos elétrons . A configuração desses elétrons segue os princípios da mecânica quântica. O número de elétrons nas camadas de elétrons de cada elemento, particularmente na camada de valência mais externa, é o fator primário na determinação de seu comportamento de ligação química. Na tabela periódica, os elementos são listados em ordem crescente de número atômico Z.
É o princípio de exclusão de Pauli que exige que os elétrons de um átomo ocupem diferentes níveis de energia, em vez de todos se condensarem no estado fundamental. A ordenação dos elétrons no estado fundamental de átomos multieletrônicos começa com o estado de energia mais baixo (estado fundamental) e se move progressivamente a partir daí na escala de energia até que cada um dos elétrons do átomo receba um conjunto único de números quânticos. Este fato tem implicações importantes para a construção da tabela periódica dos elementos.
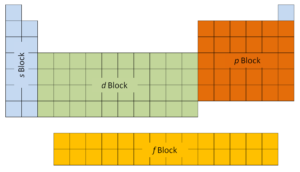 As duas primeiras colunas do lado esquerdo da tabela periódica são onde os subníveis s estão sendo ocupados. Por causa disso, as duas primeiras linhas da tabela periódica são rotuladas como o bloco s. Da mesma forma, o bloco p são as seis colunas mais à direita da tabela periódica, o bloco d são as 10 colunas intermediárias da tabela periódica, enquanto o bloco f é a seção de 14 colunas que normalmente é descrita como separada do corpo principal da tabela periódica. Poderia ser parte do corpo principal, mas então a tabela periódica seria bastante longa e complicada.
As duas primeiras colunas do lado esquerdo da tabela periódica são onde os subníveis s estão sendo ocupados. Por causa disso, as duas primeiras linhas da tabela periódica são rotuladas como o bloco s. Da mesma forma, o bloco p são as seis colunas mais à direita da tabela periódica, o bloco d são as 10 colunas intermediárias da tabela periódica, enquanto o bloco f é a seção de 14 colunas que normalmente é descrita como separada do corpo principal da tabela periódica. Poderia ser parte do corpo principal, mas então a tabela periódica seria bastante longa e complicada.
Para átomos com muitos elétrons, essa notação pode se tornar extensa e, portanto, uma notação abreviada é usada. A configuração eletrônica pode ser visualizada como os elétrons do núcleo, equivalentes ao gás nobre do período anterior, e os elétrons de valência (por exemplo, [Xe] 6s2 para o bário).
Estados de Oxidação
Os estados de oxidação são tipicamente representados por números inteiros que podem ser positivos, zero ou negativos. A maioria dos elementos tem mais de um estado de oxidação possível. Por exemplo, o carbono tem nove possíveis estados inteiros de oxidação de -4 a +4.
A definição atual do IUPAC Gold Book de estado de oxidação é:
"O estado de oxidação de um átomo é a carga desse átomo após a aproximação iônica de suas ligações heteronucleares..."
e o termo número de oxidação é quase sinônimo. Um elemento que não é combinado com nenhum outro elemento diferente tem um estado de oxidação de 0. O estado de oxidação 0 ocorre para todos os elementos – é simplesmente o elemento em sua forma elementar. Um átomo de um elemento em um composto terá um estado de oxidação positivo se tiver seus elétrons removidos. Da mesma forma, a adição de elétrons resulta em um estado de oxidação negativo. Também distinguimos entre os estados de oxidação possíveis e comuns de cada elemento. Por exemplo, o silício tem nove possíveis estados inteiros de oxidação de -4 a +4, mas apenas -4, 0 e +4 são estados de oxidação comuns.
[/with_spoiler]Resumo
| Elemento | Háfnio |
| Número de prótons | 72 |
| Número de nêutrons (isótopos típicos) | 176-178, 179, 180 |
| Número de elétrons | 72 |
| configuração eletrônica | [Veículo] 4f14 5d2 6s2 |
| Estados de oxidação | +4 |
Fonte: www.luciteria.com