Le technétium est l’élément le plus léger dont les isotopes sont tous radioactifs ; aucun n’est stable. Presque tout le technétium est produit synthétiquement et seules des quantités infimes se trouvent dans la croûte terrestre. Les propriétés chimiques de ce métal de transition gris argenté et cristallin sont intermédiaires entre le rhénium et le manganèse.
Protons et neutrons dans le Technétium
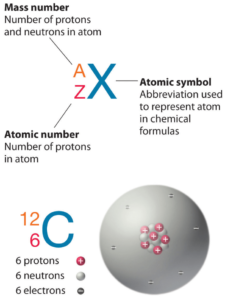 Le technétium est un élément chimique de numéro atomique 43, ce qui signifie qu’il y a 43 protons dans son noyau. Le nombre total de protons dans le noyau est appelé le numéro atomique de l’atome et reçoit le symbole Z. La charge électrique totale du noyau est donc +Ze, où e (charge élémentaire) vaut 1 602 x 10-19 coulombs.
Le technétium est un élément chimique de numéro atomique 43, ce qui signifie qu’il y a 43 protons dans son noyau. Le nombre total de protons dans le noyau est appelé le numéro atomique de l’atome et reçoit le symbole Z. La charge électrique totale du noyau est donc +Ze, où e (charge élémentaire) vaut 1 602 x 10-19 coulombs.
Le nombre total de neutrons dans le noyau d’un atome est appelé le nombre de neutrons de l’atome et reçoit le symbole N. Le nombre de neutrons plus le numéro atomique est égal au nombre de masse atomique: N+Z=A . La différence entre le nombre de neutrons et le numéro atomique est appelée excès de neutrons: D = N – Z = A – 2Z.
Pour les éléments stables, il existe généralement une variété d’isotopes stables. Les isotopes sont des nucléides qui ont le même numéro atomique et sont donc le même élément, mais diffèrent par le nombre de neutrons. Les nombres de masse des isotopes typiques du technétium sont de 97 à 99.
Principaux isotopes du Technétium
Le technétium n’est présent que dans un seul isotope naturel – 99Tc, et uniquement à l’état de traces.
Le technétium-99 est composé de 43 protons, 56 neutrons et 43 électrons.
Isotopes naturels
| Isotope | Abondance | Nombre de neutrons |
| 99Tc (instable) | trace | 56 |
[/ su_panel]
[/ su_shadow]
Isotopes instables typiques
| Isotope | Demi-vie | Mode de décomposition | Produit |
| 95mTc | 61 j | capture d’électrons | 95Mo |
| 96Tc | 4,3 j | capture d’électrons | 96Mo |
| 97Tc | 4,21×106 a | capture d’électrons | 97Mo |
| 97mTc | 91 j | IT | 97Tc |
| 98Tc | 4,2×106 a | désintégration bêta | 98Ru |
| 99Tc | 2.111×105 a | désintégration bêta | 99Ru |
[/ su_panel]
[/ su_shadow]
Électrons et configuration électronique
Le nombre d’électrons dans un atome électriquement neutre est le même que le nombre de protons dans le noyau. Par conséquent, le nombre d’électrons dans l’atome neutre de technétium est de 43. Chaque électron est influencé par les champs électriques produits par la charge nucléaire positive et les autres (Z – 1) électrons négatifs de l’atome.
Le nombre d’électrons et leur disposition étant responsables du comportement chimique des atomes, le numéro atomique identifie les différents éléments chimiques. La configuration de ces électrons découle des principes de la mécanique quantique. Le nombre d’électrons dans les couches d’électrons de chaque élément, en particulier la couche de valence la plus externe, est le principal facteur déterminant son comportement de liaison chimique. Dans le tableau périodique, les éléments sont classés par ordre croissant de numéro atomique Z.
La configuration électronique du technétium est [Kr] 4d5 5s2.
Les états d’oxydation possibles sont +4,7.
Application la plus courante du Technétium
Un isomère nucléaire émetteur de rayons gamma à courte durée de vie, le technétium-99m, est utilisé en médecine nucléaire pour une grande variété de tests, tels que le diagnostic du cancer des os.
Résumé
| Élément | Technétium |
| Nombre de protons | 43 |
| Nombre de neutrons (isotopes typiques) | 97-99 |
| Nombre d’électrons | 43 |
| Configuration électronique | [Kr] 4d5 5s2 |
| États d’oxydation | +4,7 |
Source : www.luciteria.com