O Boro natural consiste principalmente de dois isótopos estáveis, 11B (80,1%) e 10B (19,9%). Na indústria nuclear, o boro é comumente usado como um absorvedor de nêutrons devido à alta seção transversal de nêutrons do isótopo 10B. Sua seção de choque (n,alfa) de reação para nêutrons térmicos é de cerca de 3840 barns (para nêutrons de 0,025 eV). O isótopo 11B tem seção transversal de absorção para nêutrons térmicos de cerca de 0,005 barns (para nêutrons de 0,025 eV). A maioria das reações (n,alfa) de nêutrons térmicos são reações 10B (n,alfa) 7Li acompanhadas por emissão gama de 0,48 MeV.
Nos Estados Unidos, 70% do Boro é utilizado para a produção de vidro e cerâmica. O maior uso em escala industrial global de compostos de boro (cerca de 46% do uso final) é na produção de fibra de vidro para isolamento contendo boro e fibras de vidro estruturais.
Fontes economicamente importantes de Boro são os minerais colemanita, rasorita (kernita), ulexita e tincal. Juntos, eles constituem 90% do minério contendo boro extraído.
Prótons e nêutrons em Boro
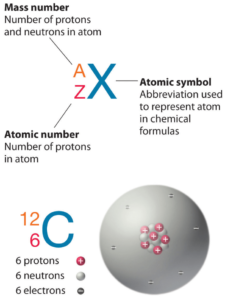 O Boro é um elemento químico com número atômico 5, o que significa que existem 5 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.
O Boro é um elemento químico com número atômico 5, o que significa que existem 5 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.
O número total de nêutrons no núcleo de um átomo é chamado de número de nêutrons do átomo e recebe o símbolo N. O número de nêutrons mais o número atômico é igual ao número de massa atômica: N+Z=A. A diferença entre o número de nêutrons e o número atômico é conhecida como excesso de nêutrons: D = N – Z = A – 2Z.
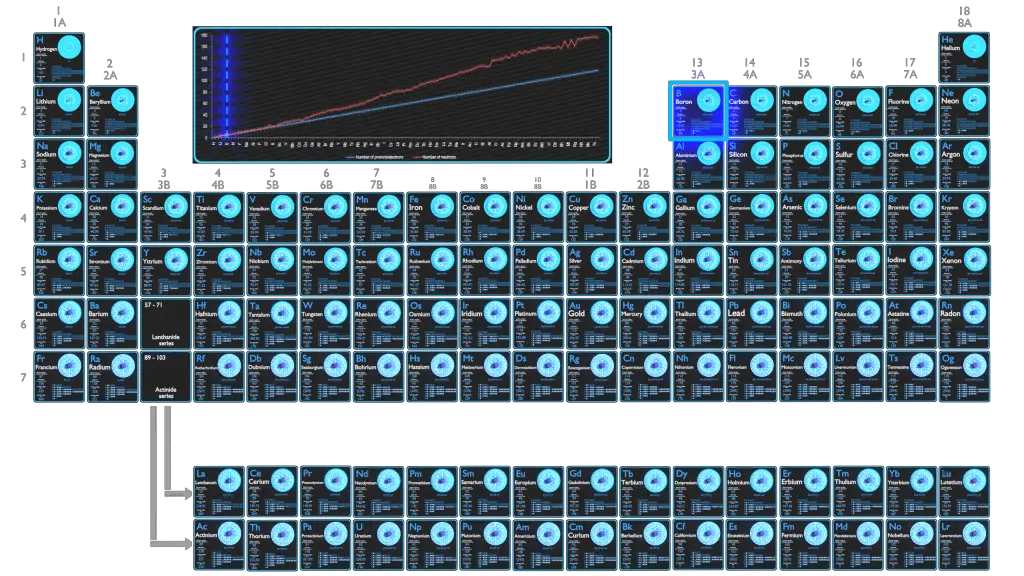
Para elementos estáveis, geralmente há uma variedade de isótopos estáveis. Isótopos são nuclídeos que possuem o mesmo número atômico e, portanto, são o mesmo elemento, mas diferem no número de nêutrons. Números de massa de isótopos típicos de Boro são 10; 11.
Principais Isótopos do Boro
Existem 13 isótopos conhecidos de boro, o isótopo de vida mais curta é o 7B, que decai por emissão de prótons e decaimento alfa. Tem uma meia-vida de 3,5 × 10−22 s. O Boro tem dois isótopos naturais e estáveis, 11B (80,1%) e 10B (19,9%).
O Boro-10 é composto de 5 prótons, 5 nêutrons e 5 elétrons. n indústria nuclear, o boro é comumente usado como um absorvedor de nêutrons devido à alta seção transversal de nêutrons do isótopo 10B. Sua seção de choque (n,alfa) de reação para nêutrons térmicos é de cerca de 3840 barns (para nêutrons de 0,025 eV). O Boro enriquecido ou 10B é usado tanto na proteção contra radiação quanto no nuclídeo primário usado na terapia de captura de nêutrons do câncer.
O Boro-11 é composto de 5 prótons, 6 nêutrons e 5 elétrons. O isótopo 11B tem seção transversal de absorção para nêutrons térmicos de cerca de 0,005 barns (para nêutrons de 0,025 eV).
Isótopos Instáveis Típicos
Elétrons e configuração eletrônica
O número de elétrons em um átomo eletricamente neutro é o mesmo que o número de prótons no núcleo. Portanto, o número de elétrons no átomo neutro do Boro é 5. Cada elétron é influenciado pelos campos elétricos produzidos pela carga nuclear positiva e os outros (Z – 1) elétrons negativos no átomo.
Como o número de elétrons e seu arranjo são responsáveis pelo comportamento químico dos átomos, o número atômico identifica os vários elementos químicos. A configuração desses elétrons segue os princípios da mecânica quântica. O número de elétrons nas camadas de elétrons de cada elemento, particularmente na camada de valência mais externa, é o fator primário na determinação de seu comportamento de ligação química. Na tabela periódica, os elementos são listados em ordem crescente de número atômico Z.
A configuração eletrônica do Boro é [He] 2s2 2p1.
Os possíveis estados de oxidação são -5; -1; +1; +2; +3.
O boro normalmente não reage com ácidos. Na forma de pó, reage com ácido nítrico quente (HNO3) e ácido sulfúrico quente (H2SO4). Também se dissolve em metais fundidos (derretidos). Nos compostos mais familiares, o boro tem o estado de oxidação formal III. Estes incluem óxidos, sulfetos, nitretos e haletos. O trifluoreto de boro é usado na indústria petroquímica como catalisador. Os haletos reagem com a água para formar ácido bórico. O boro é encontrado na natureza na Terra quase inteiramente como vários óxidos de B(III), frequentemente associados a outros elementos. Mais de cem minerais de borato contêm boro no estado de oxidação +3.
Composto Químico Mais Comum de Boro
Carboneto de Boro (fórmula química aproximadamente B4C) é uma cerâmica de boro-carbono extremamente dura e material covalente. É um dos materiais mais duros conhecidos, ocupando o terceiro lugar atrás do diamante e do nitreto de boro cúbico. É o material mais duro produzido em quantidades de tonelagem. Devido à sua alta dureza, o pó de carboneto de boro é usado como abrasivo em aplicações de polimento e lapidação, e também como abrasivo solto em aplicações de corte, como corte com jato de água.
Sobre os prótons
 Um próton é uma das partículas subatômicas que compõem a matéria. No universo, os prótons são abundantes, constituindo cerca de metade de toda a matéria visível. Tem uma carga elétrica positiva (+1e) e uma massa de repouso igual a 1,67262 × 10−27 kg (938,272 MeV/c2) — ligeiramente mais leve que a do nêutron, mas quase 1,836 vezes maior que a do elétron. O próton tem um raio quadrado médio de cerca de 0,87 × 10−15 m, ou 0,87 fm, e é um spin – ½ férmion.
Um próton é uma das partículas subatômicas que compõem a matéria. No universo, os prótons são abundantes, constituindo cerca de metade de toda a matéria visível. Tem uma carga elétrica positiva (+1e) e uma massa de repouso igual a 1,67262 × 10−27 kg (938,272 MeV/c2) — ligeiramente mais leve que a do nêutron, mas quase 1,836 vezes maior que a do elétron. O próton tem um raio quadrado médio de cerca de 0,87 × 10−15 m, ou 0,87 fm, e é um spin – ½ férmion.
Os prótons existem nos núcleos de átomos típicos, junto com suas contrapartes neutras, os nêutrons. Nêutrons e prótons, comumente chamados de núcleons, estão unidos no núcleo atômico, onde representam 99,9% da massa do átomo. A pesquisa em física de partículas de alta energia no século 20 revelou que nem o nêutron nem o próton não são o menor bloco de construção da matéria.
Sobre Neutrons
Um nêutron é uma das partículas subatômicas que compõem a matéria. No universo, os nêutrons são abundantes, constituindo mais da metade de toda a matéria visível. Ele não tem carga elétrica e uma massa de repouso igual a 1,67493 × 10−27 kg – ligeiramente maior que a do próton, mas quase 1,839 vezes maior que a do elétron. O nêutron tem um raio quadrado médio de cerca de 0,8 × 10−15 m, ou 0,8 fm, e é um férmion spin-½.
Os núcleos atômicos consistem em prótons e nêutrons, que se atraem através da força nuclear, enquanto os prótons se repelem através da força elétrica devido à sua carga positiva. Essas duas forças competem, levando a várias estabilidades de núcleos. Existem apenas certas combinações de nêutrons e prótons, que formam núcleos estáveis.
Os nêutrons estabilizam o núcleo, pois atraem uns aos outros e os prótons, o que ajuda a compensar a repulsão elétrica entre os prótons. Como resultado, à medida que o número de prótons aumenta, uma proporção crescente de nêutrons para prótons é necessária para formar um núcleo estável. Se houver muitos ou poucos nêutrons para um determinado número de prótons, o núcleo resultante não é estável e sofre decaimento radioativo. Isótopos instáveis decaem através de vários caminhos de decaimento radioativo, mais comumente decaimento alfa, decaimento beta ou captura de elétrons. Muitos outros tipos raros de decaimento, como fissão espontânea ou emissão de nêutrons, são conhecidos. Deve-se notar que todas essas vias de decaimento podem ser acompanhadas pela subsequente emissão de radiação gama. Decaimentos alfa ou beta puros são muito raros.
Sobre elétrons e configuração de elétrons
A tabela periódica é uma exibição tabular dos elementos químicos organizados com base em seus números atômicos, configurações eletrônicas e propriedades químicas. A configuração eletrônica é a distribuição de elétrons de um átomo ou molécula (ou outra estrutura física) em orbitais atômicos ou moleculares. O conhecimento da configuração eletrônica de diferentes átomos é útil para entender a estrutura da tabela periódica dos elementos.
Todo sólido, líquido, gás e plasma é composto de átomos neutros ou ionizados. As propriedades químicas do átomo são determinadas pelo número de prótons, na verdade, pelo número e disposição dos elétrons. A configuração desses elétrons segue os princípios da mecânica quântica. O número de elétrons nas camadas de elétrons de cada elemento, particularmente na camada de valência mais externa, é o fator primário na determinação de seu comportamento de ligação química. Na tabela periódica, os elementos são listados em ordem crescente de número atômico Z.
É o princípio de exclusão de Pauli que exige que os elétrons de um átomo ocupem diferentes níveis de energia, em vez de todos se condensarem no estado fundamental. A ordenação dos elétrons no estado fundamental de átomos multieletrônicos começa com o estado de energia mais baixo (estado fundamental) e se move progressivamente a partir daí na escala de energia até que cada um dos elétrons do átomo receba um conjunto único de números quânticos. Este fato tem implicações importantes para a construção da tabela periódica dos elementos.
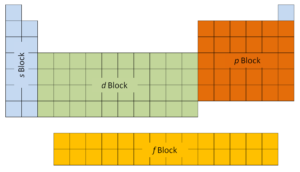 As duas primeiras colunas do lado esquerdo da tabela periódica são onde os subníveis s estão sendo ocupados. Por causa disso, as duas primeiras linhas da tabela periódica são rotuladas como o bloco s. Da mesma forma, o bloco p são as seis colunas mais à direita da tabela periódica, o bloco d são as 10 colunas intermediárias da tabela periódica, enquanto o bloco f é a seção de 14 colunas que normalmente é descrita como separada do corpo principal da tabela periódica. Poderia ser parte do corpo principal, mas então a tabela periódica seria bastante longa e complicada.
As duas primeiras colunas do lado esquerdo da tabela periódica são onde os subníveis s estão sendo ocupados. Por causa disso, as duas primeiras linhas da tabela periódica são rotuladas como o bloco s. Da mesma forma, o bloco p são as seis colunas mais à direita da tabela periódica, o bloco d são as 10 colunas intermediárias da tabela periódica, enquanto o bloco f é a seção de 14 colunas que normalmente é descrita como separada do corpo principal da tabela periódica. Poderia ser parte do corpo principal, mas então a tabela periódica seria bastante longa e complicada.
Para átomos com muitos elétrons, essa notação pode se tornar extensa e, portanto, uma notação abreviada é usada. A configuração eletrônica pode ser visualizada como os elétrons do núcleo, equivalentes ao gás nobre do período anterior, e os elétrons de valência (por exemplo, [Xe] 6s2 para o bário).
Estados de Oxidação
Os estados de oxidação são tipicamente representados por números inteiros que podem ser positivos, zero ou negativos. A maioria dos elementos tem mais de um estado de oxidação possível. Por exemplo, o carbono tem nove possíveis estados inteiros de oxidação de -4 a +4.
A definição atual do IUPAC Gold Book de estado de oxidação é:
“O estado de oxidação de um átomo é a carga desse átomo após a aproximação iônica de suas ligações heteronucleares…”
e o termo número de oxidação é quase sinônimo. Um elemento que não é combinado com nenhum outro elemento diferente tem um estado de oxidação de 0. O estado de oxidação 0 ocorre para todos os elementos – é simplesmente o elemento em sua forma elementar. Um átomo de um elemento em um composto terá um estado de oxidação positivo se tiver seus elétrons removidos. Da mesma forma, a adição de elétrons resulta em um estado de oxidação negativo. Também distinguimos entre os estados de oxidação possíveis e comuns de cada elemento. Por exemplo, o silício tem nove possíveis estados inteiros de oxidação de -4 a +4, mas apenas -4, 0 e +4 são estados de oxidação comuns.
Resumo
| Elemento |
Boro |
| Número de prótons |
5 |
| Número de nêutrons (isótopos típicos) |
10; 11 |
| Número de elétrons |
5 |
| configuração eletrônica |
[Ele] 2s2 2p1 |
| Estados de oxidação |
-5; -1; +1; +2; +3 |

Fonte: www.luciteria.com
Propriedades de outros elementos
Outras propriedades do Boro
 O Boro é um elemento químico com número atômico 5, o que significa que existem 5 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.
O Boro é um elemento químico com número atômico 5, o que significa que existem 5 prótons em seu núcleo. O número total de prótons no núcleo é chamado de número atômico do átomo e recebe o símbolo Z. A carga elétrica total do núcleo é, portanto, +Ze, onde e (carga elementar) é igual a 1,602 x 10-19 coulombs.